2025年零失误分层训练高中化学必修第二册人教版黑吉辽内蒙古专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年零失误分层训练高中化学必修第二册人教版黑吉辽内蒙古专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第10页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
2.【题型二】有一瓶$\mathrm{Na_2SO_3}$溶液,它可能部分
被氧化。某同学取该少量溶液,滴入$\mathrm{BaCl_2}$
溶液,产生白色沉淀,再加入足量稀硫酸,充
分振荡后仍有白色沉淀。对此实验下述结论
正确的是 (
A.亚硫酸钠已部分被空气中的氧气氧化
B.加入$\mathrm{BaCl_2}$溶液后,生成的沉淀中不一定
含有$\mathrm{BaSO_4}$
C.加入稀硫酸后,不溶性沉淀可能是$\mathrm{BaSO_3}$
D.此实验能确定亚硫酸钠是否被部分氧化
被氧化。某同学取该少量溶液,滴入$\mathrm{BaCl_2}$
溶液,产生白色沉淀,再加入足量稀硫酸,充
分振荡后仍有白色沉淀。对此实验下述结论
正确的是 (
B
)A.亚硫酸钠已部分被空气中的氧气氧化
B.加入$\mathrm{BaCl_2}$溶液后,生成的沉淀中不一定
含有$\mathrm{BaSO_4}$
C.加入稀硫酸后,不溶性沉淀可能是$\mathrm{BaSO_3}$
D.此实验能确定亚硫酸钠是否被部分氧化
答案:
2.B[提示:若$\mathrm{Na_2SO_3}$溶液没有被氧化,加入$\mathrm{BaCl_2}$溶液会生成$\mathrm{BaSO_3}$白色沉淀;若$\mathrm{Na_2SO_3}$部分被氧化为$\mathrm{Na_2SO_4}$,加入$\mathrm{BaCl_2}$溶液会生成$\mathrm{BaSO_3}$和$\mathrm{BaSO_4}$白色沉淀,则生成的沉淀中不一定含有$\mathrm{BaSO_4}$,故B正确;根据分析,不论$\mathrm{Na_2SO_3}$溶液是否被氧化,加入稀$\mathrm{H_2SO_4}$后,根据强酸制弱酸原理,最终生成的沉淀都是$\mathrm{BaSO_4}$,不可能含有$\mathrm{BaSO_3}$,故C错误。]
3.【题型一、四】(2025·黑龙江哈师大附中阶
段考)含S元素的某钠盐a能发生如图转化。
下列说法正确的是 (

A.a可能为正盐,也可能为酸式盐
B.溶液b含有的阴离子只有$\mathrm{SO_4^{2-}}$
C.d分子含有非极性键
D.气体d因漂白性使$\mathrm{KMnO_4}$溶液褪色
段考)含S元素的某钠盐a能发生如图转化。
下列说法正确的是 (
A
)
A.a可能为正盐,也可能为酸式盐
B.溶液b含有的阴离子只有$\mathrm{SO_4^{2-}}$
C.d分子含有非极性键
D.气体d因漂白性使$\mathrm{KMnO_4}$溶液褪色
答案:
3.A[提示:根据题图,a是$\mathrm{Na_2SO_3}$或$\mathrm{NaHSO_3}$,b溶液中含$\mathrm{Na_2SO_4}$,c是$\mathrm{BaSO_4}$,d是$\mathrm{SO_2}$。]
4.【题型三】除去粗盐中的杂质$\mathrm{CaCl_2}$、$\mathrm{MgCl_2}$和
$\mathrm{Na_2SO_4}$,过程如图所示,下列有关说法中,不
正确的是 (
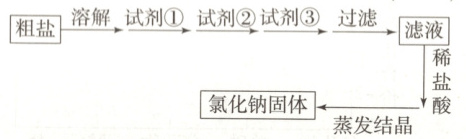
A.除去$\mathrm{Mg^{2+}}$的主要反应:$\mathrm{Mg^{2+}+2OH^-=Mg(OH)_2↓}$
B.试剂①一定不是$\mathrm{Na_2CO_3}$溶液
C.检验$\mathrm{SO_4^{2-}}$是否除尽:取少量滤液,加稀盐
酸酸化,再加$\mathrm{BaCl_2}$溶液
D.滤液加稀盐酸时只发生反应:$\mathrm{H^++OH^-=H_2O}$
$\mathrm{Na_2SO_4}$,过程如图所示,下列有关说法中,不
正确的是 (
D
)
A.除去$\mathrm{Mg^{2+}}$的主要反应:$\mathrm{Mg^{2+}+2OH^-=Mg(OH)_2↓}$
B.试剂①一定不是$\mathrm{Na_2CO_3}$溶液
C.检验$\mathrm{SO_4^{2-}}$是否除尽:取少量滤液,加稀盐
酸酸化,再加$\mathrm{BaCl_2}$溶液
D.滤液加稀盐酸时只发生反应:$\mathrm{H^++OH^-=H_2O}$
答案:
4.D[提示:A.除去$\mathrm{Mg^{2+}}$用氢氧化钠溶液,发生的主要反应为:$\mathrm{Mg^{2+}+2OH^-=Mg(OH)_2\downarrow}$,A正确;B.由于过量的氯化钡需要用碳酸钠溶液除去,因此碳酸钠溶液一定在氯化钡溶液的后面加入,则试剂①一定不是$\mathrm{Na_2CO_3}$溶液,B正确;C.检验$\mathrm{SO_4^{2-}}$是否除尽:取少量滤液,加稀盐酸酸化,再加$\mathrm{BaCl_2}$溶液,C正确;D.滤液加稀盐酸时发生反应:$\mathrm{H^++OH^-=H_2O}$、$\mathrm{2H^++CO_3^{2-}=CO_2\uparrow+H_2O}$,D错误。]
5.【题型四】(2025·湖南长沙雅礼中学月考)
由一种阳离子与两种酸根阴离子组成的盐称
为混盐。向混盐$\mathrm{Na_4S_2O_3}$中加入足量稀硫
酸,发生反应:$2\mathrm{Na_4S_2O_3+4H_2SO_4=4Na_2SO_4+3S↓+SO_2↑+4H_2O}$。下列说法正
确的是 (
A.$\mathrm{Na_4S_2O_3}$的水溶液中的阴离子只有
$\mathrm{SO_3^{2-}}$和$\mathrm{S^{2-}}$两种
B.$1\ \mathrm{mol}\ \mathrm{Na_4S_2O_3}$中共含离子数为$5N_A$
C.上述反应中,每产生$3\ \mathrm{mol}\ \mathrm{S}$,转移电子的
物质的量为$6\ \mathrm{mol}$
D.$\mathrm{CaOCl_2}$也可称为混盐,向$\mathrm{CaOCl_2}$中加
入足量稀硫酸会有$\mathrm{Cl_2}$产生
由一种阳离子与两种酸根阴离子组成的盐称
为混盐。向混盐$\mathrm{Na_4S_2O_3}$中加入足量稀硫
酸,发生反应:$2\mathrm{Na_4S_2O_3+4H_2SO_4=4Na_2SO_4+3S↓+SO_2↑+4H_2O}$。下列说法正
确的是 (
D
)A.$\mathrm{Na_4S_2O_3}$的水溶液中的阴离子只有
$\mathrm{SO_3^{2-}}$和$\mathrm{S^{2-}}$两种
B.$1\ \mathrm{mol}\ \mathrm{Na_4S_2O_3}$中共含离子数为$5N_A$
C.上述反应中,每产生$3\ \mathrm{mol}\ \mathrm{S}$,转移电子的
物质的量为$6\ \mathrm{mol}$
D.$\mathrm{CaOCl_2}$也可称为混盐,向$\mathrm{CaOCl_2}$中加
入足量稀硫酸会有$\mathrm{Cl_2}$产生
答案:
5.D[提示:$\mathrm{Na_4S_2O_3}$的水溶液中的阴离子除$\mathrm{SO_3^{2-}}$、$\mathrm{S^{2-}}$外,还有$\mathrm{OH^-}$,A错误;$\mathrm{Na_4S_2O_3}$为$\mathrm{Na_2S}$和$\mathrm{Na_2S_2}$的混盐,所以$1\ \mathrm{mol}\ \mathrm{Na_4S_2O_3}$中所含离子数为$(2\ \mathrm{mol}+1\ \mathrm{mol}+2\ \mathrm{mol}+1\ \mathrm{mol})× N_A\ \mathrm{mol^{-1}}=6N_A$,B错误;由$\mathrm{2Na_4S_2O_3+4H_2SO_4=4Na_2SO_4+3S\downarrow+SO_2\uparrow+4H_2O}$可知,产生$3\ \mathrm{mol}\ \mathrm{S}$时,有$2\ \mathrm{mol}\ \mathrm{Na_2S}$被氧化,$1\ \mathrm{mol}\ \mathrm{Na_2SO_3}$被还原,转移电子的物质的量为$4\ \mathrm{mol}$,C错误;$\mathrm{CaOCl_2}$是$\mathrm{CaCl_2}$和$\mathrm{Ca(ClO)_2}$的混盐,在酸性条件下:$\mathrm{Cl^-+ClO^-+2H^+=Cl_2\uparrow+H_2O}$,即向$\mathrm{CaOCl_2}$中加入足量稀硫酸会有$\mathrm{Cl_2}$产生,D正确。]
6.【题型四】(1)硫酸是重要的化工原料,查阅资
料,工业制硫酸的过程如图:
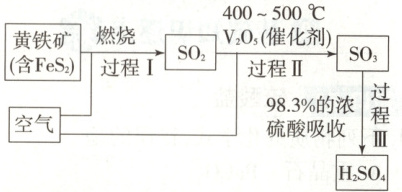
①上述过程中,没有发生氧化还原反应的
是
②过程Ⅰ的化学反应方程式为
。
③下列对浓硫酸的叙述正确的是
(填字母)。
A. 常温下,浓硫酸与铁、铝不反应,所
以铁质、铝质容器能盛放浓硫酸
B. 浓硫酸具有吸水性,故能使蔗糖
炭化
C. 浓硫酸和铜片加热时,浓硫酸既表
现出酸性,又表现出氧化性
D. 浓硫酸与亚硫酸钠反应制取$\mathrm{SO_2}$
时,浓硫酸表现出强氧化性
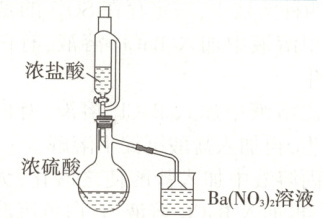
(2)某兴趣小组为验证浓硫酸的性质进行实
验,下图实验中观察到蒸馏烧瓶内有白
雾,原因是
;烧
杯中出现白色沉淀,原因是
。
料,工业制硫酸的过程如图:

①上述过程中,没有发生氧化还原反应的
是
Ⅲ
(填“Ⅰ”“Ⅱ”或“Ⅲ”)。②过程Ⅰ的化学反应方程式为
$\mathrm{4FeS_2+11O_2\xlongequal{高温}2Fe_2O_3+8SO_2}$
。
③下列对浓硫酸的叙述正确的是
C
(填字母)。
A. 常温下,浓硫酸与铁、铝不反应,所
以铁质、铝质容器能盛放浓硫酸
B. 浓硫酸具有吸水性,故能使蔗糖
炭化
C. 浓硫酸和铜片加热时,浓硫酸既表
现出酸性,又表现出氧化性
D. 浓硫酸与亚硫酸钠反应制取$\mathrm{SO_2}$
时,浓硫酸表现出强氧化性
(2)某兴趣小组为验证浓硫酸的性质进行实
验,下图实验中观察到蒸馏烧瓶内有白
雾,原因是
浓盐酸滴入浓硫酸中以后放出的热量使部分浓盐酸中的HCl挥发出来,致使烧瓶内出现白雾
;烧
杯中出现白色沉淀,原因是
HCl气体会将$\mathrm{H_2SO_4}$带出,$\mathrm{H_2SO_4}$与$\mathrm{Ba(NO_3)_2}$反应生成白色沉淀$\mathrm{BaSO_4}$
。

答案:
6.
(1)①Ⅲ ②$\mathrm{4FeS_2+11O_2\xlongequal{高温}2Fe_2O_3+8SO_2}$ ③C
(2)浓盐酸滴入浓硫酸中以后放出的热量使部分浓盐酸中的HCl挥发出来,致使烧瓶内出现白雾。HCl气体会将$\mathrm{H_2SO_4}$带出,$\mathrm{H_2SO_4}$与$\mathrm{Ba(NO_3)_2}$反应生成白色沉淀$\mathrm{BaSO_4}$
(1)①Ⅲ ②$\mathrm{4FeS_2+11O_2\xlongequal{高温}2Fe_2O_3+8SO_2}$ ③C
(2)浓盐酸滴入浓硫酸中以后放出的热量使部分浓盐酸中的HCl挥发出来,致使烧瓶内出现白雾。HCl气体会将$\mathrm{H_2SO_4}$带出,$\mathrm{H_2SO_4}$与$\mathrm{Ba(NO_3)_2}$反应生成白色沉淀$\mathrm{BaSO_4}$
7.【题型一、四】含硫化合物多为重要的化工原
料。请回答下列问题:
Ⅰ. 多硫化物是含多硫离子($\mathrm{S_x^{2-}}$)的化合物,
可用作废水处理剂、硫化剂等。
(1)$\mathrm{Na_2S_2}$的电子式为
。
(2)$ \mathrm{Na_2S_5}$(易溶于水)在酸性条件下可生
成$\mathrm{H_2S}$和S,该反应的离子方程式为
。
(3)黄铁矿(含$\mathrm{FeS_2}$)是工业上制硫酸的重要
原料,在氧气中煅烧生成$\mathrm{Fe_2O_3}$和$\mathrm{SO_2}$,
其煅烧的化学方程式为
。
Ⅱ. 焦亚硫酸钠($\mathrm{Na_2S_2O_5}$)是一种食品抗氧化
剂,易溶于水。
(4)焦亚硫酸钠($\mathrm{Na_2S_2O_5}$)中硫元素的化合
价为
(5)向某些饮料中添加少量焦亚硫酸钠
($\mathrm{Na_2S_2O_5}$),可降低饮料中溶解氧的含
量,发生反应的离子方程式为
。
(6)向饱和碳酸钠溶液中通入过量$\mathrm{SO_2}$可制
得焦亚硫酸钠,发生反应的化学方程式为
。
料。请回答下列问题:
Ⅰ. 多硫化物是含多硫离子($\mathrm{S_x^{2-}}$)的化合物,
可用作废水处理剂、硫化剂等。
(1)$\mathrm{Na_2S_2}$的电子式为
$Na^+[:\ddot{S}:\ddot{S}:]^{2-}Na^+$
。
(2)$ \mathrm{Na_2S_5}$(易溶于水)在酸性条件下可生
成$\mathrm{H_2S}$和S,该反应的离子方程式为
$S_5^{2-}+2H^+=H_2S↑+4S↓$
。
(3)黄铁矿(含$\mathrm{FeS_2}$)是工业上制硫酸的重要
原料,在氧气中煅烧生成$\mathrm{Fe_2O_3}$和$\mathrm{SO_2}$,
其煅烧的化学方程式为
$4FeS_2+11O_2\xlongequal{高温}2Fe_2O_3+8SO_2$
。
Ⅱ. 焦亚硫酸钠($\mathrm{Na_2S_2O_5}$)是一种食品抗氧化
剂,易溶于水。
(4)焦亚硫酸钠($\mathrm{Na_2S_2O_5}$)中硫元素的化合
价为
+4
。(5)向某些饮料中添加少量焦亚硫酸钠
($\mathrm{Na_2S_2O_5}$),可降低饮料中溶解氧的含
量,发生反应的离子方程式为
$S_2O_3^{2-}+O_2+H_2O=2SO_4^{2-}+2H^+$
。
(6)向饱和碳酸钠溶液中通入过量$\mathrm{SO_2}$可制
得焦亚硫酸钠,发生反应的化学方程式为
$Na_2CO_3+2SO_2=Na_2S_2O_5+CO_2$
。
答案:
7.
(1)$\mathrm{Na^+[:\ddot{S}:\ddot{S}:]^{2-}Na^+}$
(2)$\mathrm{S_5^{2-}+2H^+=H_2S\uparrow+4S\downarrow}$
(3)$\mathrm{4FeS_2+11O_2\xlongequal{高温}2Fe_2O_3+8SO_2}$
(4)+4
(5)$\mathrm{S_2O_3^{2-}+O_2+H_2O=2SO_4^{2-}+2H^+}$
(6)$\mathrm{Na_2CO_3+2SO_2=Na_2S_2O_5+CO_2}$
(1)$\mathrm{Na^+[:\ddot{S}:\ddot{S}:]^{2-}Na^+}$
(2)$\mathrm{S_5^{2-}+2H^+=H_2S\uparrow+4S\downarrow}$
(3)$\mathrm{4FeS_2+11O_2\xlongequal{高温}2Fe_2O_3+8SO_2}$
(4)+4
(5)$\mathrm{S_2O_3^{2-}+O_2+H_2O=2SO_4^{2-}+2H^+}$
(6)$\mathrm{Na_2CO_3+2SO_2=Na_2S_2O_5+CO_2}$
查看更多完整答案,请扫码查看


