2025年零失误分层训练高中化学必修第二册人教版黑吉辽内蒙古专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年零失误分层训练高中化学必修第二册人教版黑吉辽内蒙古专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第55页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
3.(2025·北京)为理解离子化合物溶解过程的能量变化,可设想$NaCl$固体溶于水的过程分两步实现,示意图如下。
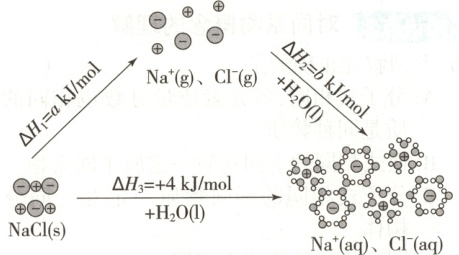
下列说法不正确的是(
A.$NaCl$固体溶解是吸热过程
B.根据盖斯定律可知:$a + b = 4$
C.根据各微粒的状态,可判断$a > 0$,$b > 0$
D.溶解过程的能量变化,与$NaCl$固体和$NaCl$溶液中微粒间作用力的强弱有关

下列说法不正确的是(
C
)A.$NaCl$固体溶解是吸热过程
B.根据盖斯定律可知:$a + b = 4$
C.根据各微粒的状态,可判断$a > 0$,$b > 0$
D.溶解过程的能量变化,与$NaCl$固体和$NaCl$溶液中微粒间作用力的强弱有关
答案:
3.C[提示:A.由图可知,$\mathrm{NaCl}$固体溶解过程的$\Delta H_3 = +4\mathrm{kJ}/\mathrm{mol}$,为吸热过程,A正确;B.由图可知,$\mathrm{NaCl}$固体溶于水的过程分两步实现,由盖斯定律可知$\Delta H_3 = \Delta H_1+\Delta H_2$,即$a + b = 4$,B正确;C.由图可知,第一步为$\mathrm{NaCl}$固体变为$\mathrm{Na}^+(\mathrm{g})$和$\mathrm{Cl}^-(\mathrm{g})$,此过程离子键发生断裂,为吸热过程,$a>0$,第二步为$\mathrm{Na}^+$和$\mathrm{Cl}^-$与水结合形成水合钠离子和水合氯离子,为放热过程,$b<0$,C错误;D.溶解过程的能量变化,与$\mathrm{NaCl}$固体断键吸收的热量及$\mathrm{Na}^+$和$\mathrm{Cl}^-$水合过程放出的热量有关,即与$\mathrm{NaCl}$固体和$\mathrm{NaCl}$溶液中微粒间作用力的强弱有关,D正确。故选C。]
4.(全国甲)一种水性电解液$Zn-MnO_2$离子选择双隔膜电池如图所示[$KOH$溶液中,$Zn^{2+}$以$Zn(OH)_4^{2-}$存在]。电池放电时,下列叙述错误的是(
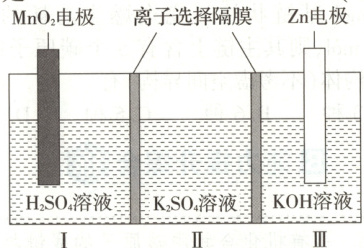
A.Ⅱ区的$K^+$通过隔膜向Ⅲ区迁移
B.Ⅰ区的$SO_4^{2-}$通过隔膜向Ⅱ区迁移
C.$MnO_2$电极反应:$MnO_{2}+2e^{-}+4H^{+}\xlongequal{}Mn^{2 + }+2H_{2}O$
D.电池总反应:$Zn + 4OH^{-}+MnO_{2}+4H^{+}\xlongequal{}Zn(OH)_{4}^{2 - }+Mn^{2 + }+2H_{2}O$
A
)
A.Ⅱ区的$K^+$通过隔膜向Ⅲ区迁移
B.Ⅰ区的$SO_4^{2-}$通过隔膜向Ⅱ区迁移
C.$MnO_2$电极反应:$MnO_{2}+2e^{-}+4H^{+}\xlongequal{}Mn^{2 + }+2H_{2}O$
D.电池总反应:$Zn + 4OH^{-}+MnO_{2}+4H^{+}\xlongequal{}Zn(OH)_{4}^{2 - }+Mn^{2 + }+2H_{2}O$
答案:
4. A[提示:根据图示的电池结构和题目所给信息可知,Ⅲ区 Zn 为电池的负极,电极反应为 Zn - 2e⁻ + 4OH⁻ == Zn(OH)₄²⁻,Ⅰ区 MnO₂为电池的正极,电极反应为 MnO₂ + 2e⁻ + 4H⁺ == Mn²⁺ + 2H₂O;电池在工作过程中,由于两个离子选择隔膜没有指明是阳离子隔膜还是阴离子隔膜,故两个离子隔膜均可以通过阴、阳离子,因此可以得到Ⅰ区消耗 H⁺,生成 Mn²⁺,Ⅱ区的 K⁺向Ⅰ区移动或Ⅰ区的 SO₄²⁻向Ⅱ区移动,Ⅲ区消耗 OH⁻,生成 Zn(OH)₄²⁻,Ⅱ区的 SO₄²⁻向Ⅲ区移动或Ⅲ区的 K⁺向Ⅱ区移动。据此分析答题。A. 根据分析,Ⅱ区的 K⁺只能向Ⅰ区移动,A 错误;B. 根据分析,Ⅰ区的 SO₄²⁻向Ⅱ区移动,B 正确;C. MnO₂电极的电极反应式为 MnO₂ + 2e⁻ + 4H⁺ == Mn²⁺ + 2H₂O,C 正确;D. 电池的总反应为 Zn + 4OH⁻ + MnO₂ + 4H⁺ == Zn(OH)₄²⁻ + Mn²⁺ + 2H₂O,D 正确。]
5.(2025·黑吉辽)一种基于$Cu_2O$的储氯电池装置如图,放电过程中$a$、$b$极均增重。若将$b$极换成$Ag/AgCl$电极,$b$极仍增重。关于图示装置所示电池,下列说法错误的是(
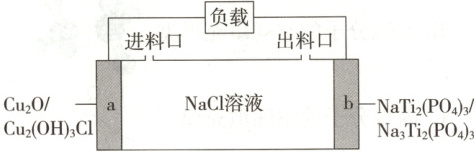
A.放电时$Na^+$向$b$极迁移
B.该电池可用于海水脱盐
C.$a$极反应:${Cu_{2}O + 2H_{2}O + Cl^{-} - 2e^{-} = Cu_{2}(OH)_{3}Cl + H^{+}}$
D.若以$Ag/AgCl$电极代替$a$极,电池将失去储氯能力
D
)
A.放电时$Na^+$向$b$极迁移
B.该电池可用于海水脱盐
C.$a$极反应:${Cu_{2}O + 2H_{2}O + Cl^{-} - 2e^{-} = Cu_{2}(OH)_{3}Cl + H^{+}}$
D.若以$Ag/AgCl$电极代替$a$极,电池将失去储氯能力
答案:
5.D[提示:A.放电时b电极是正极,阳离子向正极移动,所以$\mathrm{Na}^+$向b极迁移,A正确;B.负极消耗氯离子,正极消耗钠离子,所以该电池可用于海水脱盐,B正确;C.a电极是负极,电极反应式为 Cu₂O + 2H₂O + Cl⁻ - 2e⁻ == Cu₂(OH)₃Cl + H⁺,C正确;D.若以$\mathrm{Ag}/\mathrm{AgCl}$电极代替a极,此时$\mathrm{Ag}$失去电子,结合氯离子生成氯化银,所以电池不会失去储氯能力,D错误。答案选D。]
6.(全国乙)电池比能量高,在汽车、航天等领域具有良好的应用前景。近年来科学家研究了一种光照充电电池(如图所示)。光照时,光催化电极产生电子()和空穴(),驱动阴极反应 ($Li^{+} + e^{-} \xlongequal{} Li$) 和阳极反应 ($Li_{2}O_{2} + 2h^{+} \xlongequal{} 2Li^{+} + O_{2}$) 对电池进行充电。下列叙述错误的是 ( )
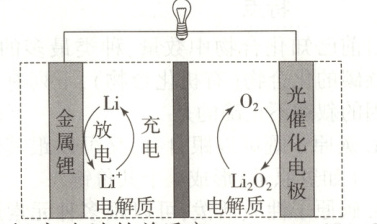
A.充电时,电池的总反应$Li_{2}O_{2} \xlongequal{} 2Li + O_{2}$
B.充电效率与光照产生的电子和空穴量有关
C.放电时,$Li^+$从正极穿过离子交换膜向负极迁移
D.放电时,正极发生反应$O_{2} + 2Li^{+} + 2e^{-} \xlongequal{} Li_{2}O_{2}$

A.充电时,电池的总反应$Li_{2}O_{2} \xlongequal{} 2Li + O_{2}$
B.充电效率与光照产生的电子和空穴量有关
C.放电时,$Li^+$从正极穿过离子交换膜向负极迁移
D.放电时,正极发生反应$O_{2} + 2Li^{+} + 2e^{-} \xlongequal{} Li_{2}O_{2}$
答案:
6. C[提示:充电时光照光催化电极产生电子和空穴,驱动阴极反应(${Li^{+} + e^{-}\xlongequal{}Li^{+}}$)和阳极反应(${Li_{2}O_{2} + 2h^{+}\xlongequal{}2Li^{+} + O_{2}}$),则充电时总反应为${Li_{2}O_{2}\xlongequal{}2Li + O_{2}}$,结合图示,充电时金属${Li}$电极为阴极,光催化电极为阳极,则放电时金属${Li}$电极为负极,光催化电极为正极,据此作答。A.光照时,光催化电极产生电子和空穴,驱动阴极反应和阳极反应对电池进行充电,结合阴极反应和阳极反应,充电时电池的总反应为${Li_{2}O_{2}\xlongequal{}2Li + O_{2}}$,A正确;B.充电时,光照光催化电极产生电子和空穴,阴极反应与电子有关,阳极反应与空穴有关,故充电效率与光照产生的电子和空穴量有关,B正确;C.放电时,金属${Li}$电极为负极,光催化电极为正极,${Li^{+}}$从负极穿过离子交换膜向正极迁移,C错误;D.放电时总反应为${2Li + O_{2}\xlongequal{}Li_{2}O_{2}}$,正极反应为${O_{2} + 2Li^{+} + 2e^{-}\xlongequal{}Li_{2}O_{2}}$,D正确。]
7. A
7. A
7.(2025·江苏)甘油($C_3H_8O_3$)水蒸气重整获得$H_2$过程中的主要反应:
反应Ⅰ $C_3H_8O_3(g) \rightleftharpoons 3CO(g) + 4H_2(g)$ $\Delta H > 0$
反应Ⅱ $CO(g) + H_2O(g) \rightleftharpoons CO_2(g) + H_2(g)$ $\Delta H < 0$
反应Ⅲ $CO_2(g) + 4H_2(g) \rightleftharpoons CH_4(g) + 2H_2O(g)$ $\Delta H < 0$
$1.0 × 10^5\ Pa$条件下,$1\ mol\ C_3H_8O_3$和$9\ mol\ H_2O$发生上述反应达平衡状态时,体系中$CO$、$H_2$、$CO_2$和$CH_4$的物质的量随温度变化的理论计算结果如图所示。下列说法正确的是(
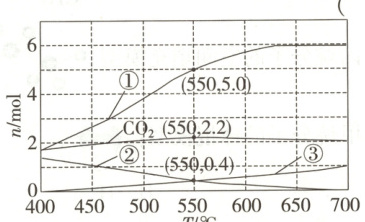
A.$550\ \degree C$时,$H_2O$的平衡转化率为$20\%$
B.$550\ \degree C$反应达平衡状态时,$n(CO_2) : n(CO) = 11 : 25$
C.其他条件不变,在$400 \sim 550\ \degree C$范围,平衡时$H_2O$的物质的量随温度升高而增大
D.其他条件不变,加压有利于增大平衡时$H_2$的物质的量
反应Ⅰ $C_3H_8O_3(g) \rightleftharpoons 3CO(g) + 4H_2(g)$ $\Delta H > 0$
反应Ⅱ $CO(g) + H_2O(g) \rightleftharpoons CO_2(g) + H_2(g)$ $\Delta H < 0$
反应Ⅲ $CO_2(g) + 4H_2(g) \rightleftharpoons CH_4(g) + 2H_2O(g)$ $\Delta H < 0$
$1.0 × 10^5\ Pa$条件下,$1\ mol\ C_3H_8O_3$和$9\ mol\ H_2O$发生上述反应达平衡状态时,体系中$CO$、$H_2$、$CO_2$和$CH_4$的物质的量随温度变化的理论计算结果如图所示。下列说法正确的是(
A
)
A.$550\ \degree C$时,$H_2O$的平衡转化率为$20\%$
B.$550\ \degree C$反应达平衡状态时,$n(CO_2) : n(CO) = 11 : 25$
C.其他条件不变,在$400 \sim 550\ \degree C$范围,平衡时$H_2O$的物质的量随温度升高而增大
D.其他条件不变,加压有利于增大平衡时$H_2$的物质的量
答案:
7.A[提示:升高温度,吸热反应平衡正向移动,放热反应平衡逆向移动,结合反应Ⅰ为吸热反应,反应Ⅱ、Ⅲ为放热反应可知,升高温度,反应Ⅰ平衡正向移动,反应Ⅱ、Ⅲ平衡逆向移动,由$\mathrm{CH_4}$只为反应Ⅲ的生成物可知,随温度升高,$n(\mathrm{CH_4})$减小,故曲线②为$\mathrm{CH_4}$的物质的量随温度的变化;由反应Ⅰ、Ⅱ中$\mathrm{CO}$和$\mathrm{H_2}$的化学计量数及反应Ⅲ平衡逆向移动,导致$n(\mathrm{H_2})$增大可知,$n(\mathrm{H_2})>n(\mathrm{CO})$,故曲线①③分别为$\mathrm{H_2}$、$\mathrm{CO}$的物质的量随温度的变化,由氢原子守恒可列式:$2n_平(\mathrm{H_2})+4n_平(\mathrm{CH_4})+2n_平(\mathrm{H_2O}) = 8n_始(\mathrm{C_3H_8O_3})+2n_始(\mathrm{H_2O}) = 1\mathrm{mol}×8 + 9\mathrm{mol}×2 =26\mathrm{mol}$,由图可知,$550°\mathrm{C}$时,$n(\mathrm{H_2}) = 5.0\mathrm{mol}$,$n(\mathrm{CH_4}) =0.4\mathrm{mol}$,即$5.0\mathrm{mol}×2 + 0.4\mathrm{mol}×4 + 2n_平(\mathrm{H_2O}) = 26\mathrm{mol}$,解得$n_平(\mathrm{H_2O}) = 7.2\mathrm{mol}$,则$550°\mathrm{C}$时,$\mathrm{H_2O}$的平衡转化率为$\frac{9\mathrm{mol}-7.2\mathrm{mol}}{9\mathrm{mol}}×100\% = 20\%$,A正确;由图可知,$550°\mathrm{C}$时,$n(\mathrm{CO_2}) = 2.2\mathrm{mol}$,$n(\mathrm{CO}) = 0.4\mathrm{mol}$,则$n(\mathrm{CO_2}):n(\mathrm{CO}) =2.2\mathrm{mol}:0.4\mathrm{mol} = 11:2$,B错误;由图可知,$400\sim550°\mathrm{C}$范围内,升高温度,$n_平(\mathrm{H_2})$的增大程度大于$n_平(\mathrm{CH_4})$的减小程度,结合A项中$2n_平(\mathrm{H_2})+4n_平(\mathrm{CH_4})+2n_平(\mathrm{H_2O}) = 26\mathrm{mol}$可知,$400\sim550°\mathrm{C}$范围内升高温度,$n_平(\mathrm{H_2O})$减小,C错误;$\mathrm{H_2}$为反应Ⅰ、Ⅱ的生成物,为反应Ⅲ的反应物,其他条件不变时,加压,反应Ⅰ平衡逆向移动,反应Ⅱ平衡不移动,反应Ⅲ平衡正向移动,则平衡时$n(\mathrm{H_2})$减小,D错误。]
查看更多完整答案,请扫码查看


