第47页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
1. 从安全、环保、节能、简便等方面考虑,实验室制取氧气的最佳方法是( )
A.通电分解水
B.加热分解高锰酸钾
C.向过氧化氢溶液中加入二氧化锰
D.加热氯酸钾和二氧化锰的混合物
A.通电分解水
B.加热分解高锰酸钾
C.向过氧化氢溶液中加入二氧化锰
D.加热氯酸钾和二氧化锰的混合物
答案:
C
2. (新教材改编)欣欣在实验室用过氧化氢溶液制取氧气时,忘记加二氧化锰,与加入二氧化锰相比,其结果是( )
A.过氧化氢不产生氧气
B.过氧化氢产生氧气的速率不改变
C.过氧化氢产生氧气的质量会减少
D.产生氧气的质量不变,但反应速率变慢
A.过氧化氢不产生氧气
B.过氧化氢产生氧气的速率不改变
C.过氧化氢产生氧气的质量会减少
D.产生氧气的质量不变,但反应速率变慢
答案:
D
3. 下列有关催化剂的说法,错误的是( )
A.催化剂能够改变化学反应速率
B.在化学反应前后其本身质量不变
C.在化学反应前后其化学性质不变
D.没有催化剂,化学反应就不会发生
A.催化剂能够改变化学反应速率
B.在化学反应前后其本身质量不变
C.在化学反应前后其化学性质不变
D.没有催化剂,化学反应就不会发生
答案:
D
4. (新教材改编)下列反应中,不属于分解反应的是( )
A.碳+氧气$\xrightarrow{点燃}$二氧化碳
B.过氧化氢$\xrightarrow{二氧化锰}$水+氧气
C.氯酸钾$\xrightarrow[加热]{二氧化锰}$氯化钾+氧气
D.高锰酸钾$\xrightarrow{加热}$锰酸钾+二氧化锰+氧气
A.碳+氧气$\xrightarrow{点燃}$二氧化碳
B.过氧化氢$\xrightarrow{二氧化锰}$水+氧气
C.氯酸钾$\xrightarrow[加热]{二氧化锰}$氯化钾+氧气
D.高锰酸钾$\xrightarrow{加热}$锰酸钾+二氧化锰+氧气
答案:
A
5. 工业上“分离液态空气法”制氧气流程如图所示,下列说法中错误的是( )
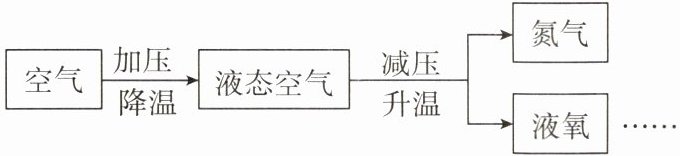
A.该分离过程是物理变化
B.该方法可以得到纯净的氧气
C.利用的是液氮比液氧沸点低
D.工业制氧气的原料来源广泛

A.该分离过程是物理变化
B.该方法可以得到纯净的氧气
C.利用的是液氮比液氧沸点低
D.工业制氧气的原料来源广泛
答案:
B
6. 如图是柯柯用过氧化氢溶液和二氧化锰完成氧气的制取、收集和验满的主要操作过程,其中需要纠正的是( )
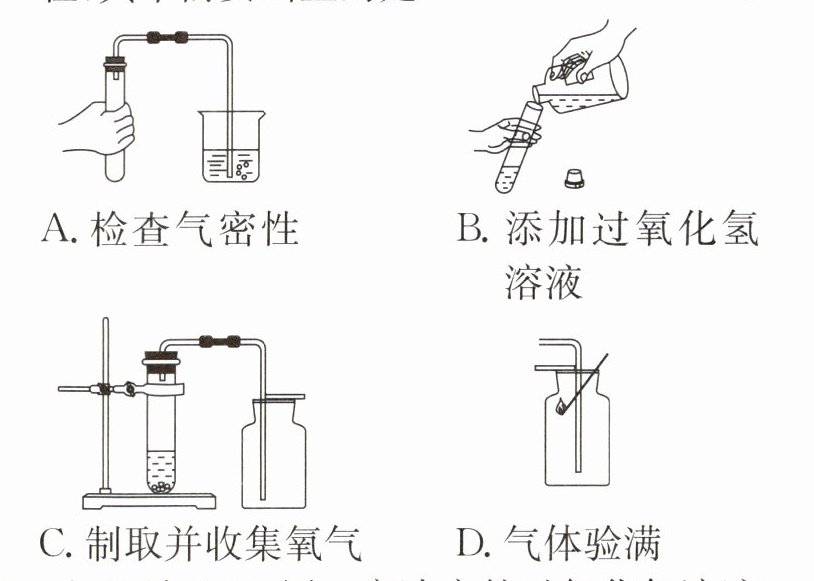

答案:
D
7. (新教材改编)用一定浓度的过氧化氢溶液和一定量的二氧化锰做如图所示的实验。
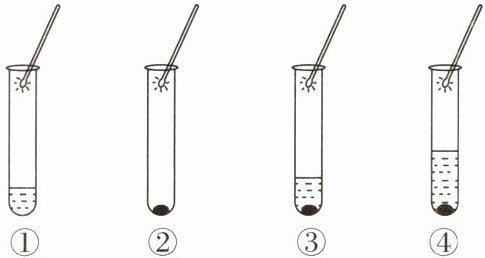
(1) 实验①:向盛有4mL过氧化氢溶液的试管中伸入带火星的木条,观察到木条______,是因为常温下过氧化氢溶液分解很慢,几乎不产生氧气。
(2) 实验②:称量0.2g二氧化锰放入试管中,然后伸入带火星的木条,观察到木条______,是因为常温下二氧化锰不能分解产生氧气。
(3) 实验③:向盛有4mL过氧化氢溶液和0.2g二氧化锰的试管中伸入带火星的木条,观察到试管内产生较多气泡,带火星的木条______。通过实验①、③,可作出推断:______。
(4) 实验④:待实验③中试管内不再产生气泡时,再次添加4mL过氧化氢溶液,观察到试管中产生较多气泡,伸入带火星的木条,木条______。重复该操作多次,均观察到相同的现象,实验④设计目的是______。
(5) 实验④完成后,将二氧化锰回收、干燥、再称量,发现其质量与反应前______。
(6) 以上研究采用了______实验的方法。

(1) 实验①:向盛有4mL过氧化氢溶液的试管中伸入带火星的木条,观察到木条______,是因为常温下过氧化氢溶液分解很慢,几乎不产生氧气。
(2) 实验②:称量0.2g二氧化锰放入试管中,然后伸入带火星的木条,观察到木条______,是因为常温下二氧化锰不能分解产生氧气。
(3) 实验③:向盛有4mL过氧化氢溶液和0.2g二氧化锰的试管中伸入带火星的木条,观察到试管内产生较多气泡,带火星的木条______。通过实验①、③,可作出推断:______。
(4) 实验④:待实验③中试管内不再产生气泡时,再次添加4mL过氧化氢溶液,观察到试管中产生较多气泡,伸入带火星的木条,木条______。重复该操作多次,均观察到相同的现象,实验④设计目的是______。
(5) 实验④完成后,将二氧化锰回收、干燥、再称量,发现其质量与反应前______。
(6) 以上研究采用了______实验的方法。
答案:
(1)不复燃(或没有明显变化)
(2)不复燃(或没有明显变化)
(3)复燃 二氧化锰能加快过氧化氢的分解速率
(4)复燃 证明反应前后二氧化锰的化学性质没有改变
(5)相等
(6)对比
(1)不复燃(或没有明显变化)
(2)不复燃(或没有明显变化)
(3)复燃 二氧化锰能加快过氧化氢的分解速率
(4)复燃 证明反应前后二氧化锰的化学性质没有改变
(5)相等
(6)对比
查看更多完整答案,请扫码查看


