第57页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
10.(2024·陕西)人类文明的进步,得益于化学的不断发展。
(1)石器时代:火的使用推动了人类文明的进程,古人钻木取火,说明燃烧需达到可燃物的______。
(2)青铜时代:青铜的硬度远比纯铜______(填“大”或“小”),因而能够取代石器和陶器,在当时社会生产、生活许多领域发挥了重要作用。
(3)蒸汽时代:蒸汽机的动力之源是煤炭,煤、______、天然气是广泛使用的化石能源。
(4)信息时代:芯片制造是信息产业的核心技术,硅是制造芯片的主要材料,用SiO₂来制取,SiO₂中硅元素的化合价为______。
(1)石器时代:火的使用推动了人类文明的进程,古人钻木取火,说明燃烧需达到可燃物的______。
(2)青铜时代:青铜的硬度远比纯铜______(填“大”或“小”),因而能够取代石器和陶器,在当时社会生产、生活许多领域发挥了重要作用。
(3)蒸汽时代:蒸汽机的动力之源是煤炭,煤、______、天然气是广泛使用的化石能源。
(4)信息时代:芯片制造是信息产业的核心技术,硅是制造芯片的主要材料,用SiO₂来制取,SiO₂中硅元素的化合价为______。
答案:
(1) 着火点
(2) 大
(3) 石油
(4) +4
(1) 着火点
(2) 大
(3) 石油
(4) +4
11.(2024·扬州改编)燃料的发热量可以用每克燃料在一定条件下完全燃烧所释放出的热量表示。天然气和甲醇均可用作燃料,其发热量及CO₂排放量如表所示。

(1)由表格可知,与甲醇相比,天然气作为燃料的优点是______________________________。
(2)甲醇(CH₄O)的组成可以看作mCH₂·nH₂O,m∶n=______。

(1)由表格可知,与甲醇相比,天然气作为燃料的优点是______________________________。
(2)甲醇(CH₄O)的组成可以看作mCH₂·nH₂O,m∶n=______。
答案:
(1) 相同质量的天然气和甲醇完全燃烧,天然气发热量高,二氧化碳排放量少
(2) 1 : 1 解析:
(1) 由表中数据可知,与甲醇相比,天然气作为燃料的优点是相同质量的天然气和甲醇完全燃烧,天然气发热量高,二氧化碳排放量少。
(2) 甲醇(CH₄O)的组成可以看作mCH₂·nH₂O,根据原子种类和原子数目不变可知,m = 1,n = 1,则m : n = 1 : 1。
(1) 相同质量的天然气和甲醇完全燃烧,天然气发热量高,二氧化碳排放量少
(2) 1 : 1 解析:
(1) 由表中数据可知,与甲醇相比,天然气作为燃料的优点是相同质量的天然气和甲醇完全燃烧,天然气发热量高,二氧化碳排放量少。
(2) 甲醇(CH₄O)的组成可以看作mCH₂·nH₂O,根据原子种类和原子数目不变可知,m = 1,n = 1,则m : n = 1 : 1。
12.(2024·扬州改编)煤炭中含有的碳酸盐会影响其发热量。测量煤炭中碳酸盐含量的原理是通过碳酸盐与盐酸反应生成CO₂的质量进行计算。实验方案为实验①,如图所示,取一定质量的煤炭样品于三颈烧瓶中,通入N₂,一段时间后加入足量稀盐酸充分反应,测量装置乙吸收气体的质量;实验②,保持其他实验条件相同,三颈烧瓶中不加煤炭样品,重复上述实验。(已知:煤炭样品与稀盐酸反应会产生少量H₂S气体,影响CO₂质量的测量)
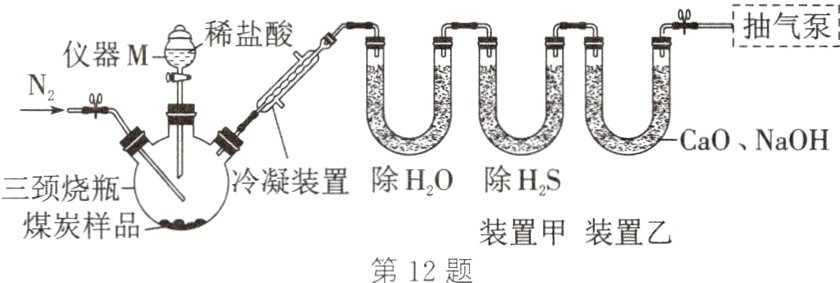
(1)仪器M的名称为______。将仪器M中的稀盐酸加入三颈烧瓶时,不应全部加入,在仍剩余少量稀盐酸时需关闭活塞,原因是______________________________。
(2)进行实验①时,装置甲中盛有的CuSO₄能与H₂S发生复分解反应,生成CuS沉淀和一种常见的强酸,反应的化学方程式为______________________________;反应结束后,需向装置中继续通入一段时间的N₂,作用是______________________________。
(3)进行实验②的目的是______________________________。

(1)仪器M的名称为______。将仪器M中的稀盐酸加入三颈烧瓶时,不应全部加入,在仍剩余少量稀盐酸时需关闭活塞,原因是______________________________。
(2)进行实验①时,装置甲中盛有的CuSO₄能与H₂S发生复分解反应,生成CuS沉淀和一种常见的强酸,反应的化学方程式为______________________________;反应结束后,需向装置中继续通入一段时间的N₂,作用是______________________________。
(3)进行实验②的目的是______________________________。
答案:
(1) 分液漏斗 形成液封,保证装置的气密性,防止气体逸出
(2) CuSO₄ + H₂S == CuS↓ + H₂SO₄ 保证装置中的二氧化碳全部被装置乙吸收
(3) 作对照,保证实验结果的准确性 解析:
(1) 由图可知,仪器M的名称为分液漏斗,为了形成液封,保证装置的气密性,防止气体逸出,将仪器M中的稀盐酸加入三颈烧瓶时,不应全部加入,在仍剩余少量稀盐酸时需关闭活塞。
(2) CuSO₄能与H₂S互相交换成分,发生复分解反应,生成CuS沉淀和硫酸,反应的化学方程式为CuSO₄ + H₂S == CuS↓ + H₂SO₄,为了保证装置中的二氧化碳全部被乙吸收,反应结束后,需向装置中继续通入一段时间的N₂。
(3) 实验2是对照实验,则进行实验2的目的是作对照,保证实验结果的准确性。
(1) 分液漏斗 形成液封,保证装置的气密性,防止气体逸出
(2) CuSO₄ + H₂S == CuS↓ + H₂SO₄ 保证装置中的二氧化碳全部被装置乙吸收
(3) 作对照,保证实验结果的准确性 解析:
(1) 由图可知,仪器M的名称为分液漏斗,为了形成液封,保证装置的气密性,防止气体逸出,将仪器M中的稀盐酸加入三颈烧瓶时,不应全部加入,在仍剩余少量稀盐酸时需关闭活塞。
(2) CuSO₄能与H₂S互相交换成分,发生复分解反应,生成CuS沉淀和硫酸,反应的化学方程式为CuSO₄ + H₂S == CuS↓ + H₂SO₄,为了保证装置中的二氧化碳全部被乙吸收,反应结束后,需向装置中继续通入一段时间的N₂。
(3) 实验2是对照实验,则进行实验2的目的是作对照,保证实验结果的准确性。
查看更多完整答案,请扫码查看


