第40页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
1.(2024·甘肃)果蔬专用洗涤盐中含有小苏打。小苏打属于( )
A. 酸
B. 碱
C. 盐
D. 混合物
A. 酸
B. 碱
C. 盐
D. 混合物
答案:
C
2. 根据盐的溶解性表判断,下列叙述正确的是( )
A. 硝酸盐都能溶于水
B. 碳酸盐都不溶于水
C. 硫酸盐少数溶于水
D. 盐酸盐都能溶于水
A. 硝酸盐都能溶于水
B. 碳酸盐都不溶于水
C. 硫酸盐少数溶于水
D. 盐酸盐都能溶于水
答案:
A
3.(2024·临夏)金属镍(Ni)在制造钱币、不锈钢、催化剂等方面有着广泛的应用。为探究镍、锌、铜的金属活动性顺序,小明做了如图所示的实验,发现A试管中镍丝表面无现象,B试管中镍丝表面出现红色物质,则三种金属活动性由强到弱的顺序是( )
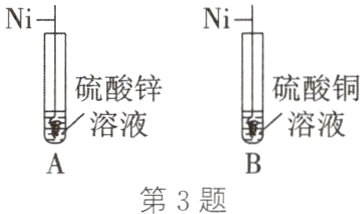
A. Ni、Zn、Cu
B. Zn、Cu、Ni
C. Zn、Ni、Cu
D. Cu、Ni、Zn

A. Ni、Zn、Cu
B. Zn、Cu、Ni
C. Zn、Ni、Cu
D. Cu、Ni、Zn
答案:
C
4. 现有Zn、Cu、Ag三种金属,每种金属限用一次,只用一种试剂就可以验证它们的金属活动性强弱,则该试剂是( )
A. AgNO₃溶液
B. CuSO₄溶液
C. 稀硫酸溶液
D. ZnCl₂溶液
A. AgNO₃溶液
B. CuSO₄溶液
C. 稀硫酸溶液
D. ZnCl₂溶液
答案:
B
5. 下列各组溶液混合后,能发生化学反应且溶液总质量不变的是( )
A. 氢氧化钠溶液和稀硫酸
B. 硫酸铜溶液和氯化钡溶液
C. 氢氧化钾溶液和氯化钠溶液
D. 碳酸钠溶液和稀盐酸
A. 氢氧化钠溶液和稀硫酸
B. 硫酸铜溶液和氯化钡溶液
C. 氢氧化钾溶液和氯化钠溶液
D. 碳酸钠溶液和稀盐酸
答案:
A
6. 酸、碱、盐在溶液中发生复分解反应的条件是有沉淀析出,或有气体放出,或有水生成。下列各组物质在水溶液中不能发生复分解反应的是( )
A. AgNO₃和NaCl
B. KNO₃和Ca(OH)₂
C. Ba(OH)₂和H₂SO₄
D. CaCO₃和HCl
A. AgNO₃和NaCl
B. KNO₃和Ca(OH)₂
C. Ba(OH)₂和H₂SO₄
D. CaCO₃和HCl
答案:
B
7. 某溶液中大量存在着四种离子。对这四种离子的判断,正确的是( )
A. K⁺、Cu²⁺、SO₄²⁻、NO₃⁻
B. H⁺、Ca²⁺、Cl⁻、OH⁻
C. Fe³⁺、Na⁺、OH⁻、SO₄²⁻
D. H⁺、Ag⁺、CO₃²⁻、NO₃⁻
A. K⁺、Cu²⁺、SO₄²⁻、NO₃⁻
B. H⁺、Ca²⁺、Cl⁻、OH⁻
C. Fe³⁺、Na⁺、OH⁻、SO₄²⁻
D. H⁺、Ag⁺、CO₃²⁻、NO₃⁻
答案:
A
8. 能将硝酸银溶液、碳酸钠溶液、氯化钾溶液鉴别开来的试剂是( )
A. 铜丝
B. 硝酸钠溶液
C. 稀盐酸
D. 氢氧化钠溶液
A. 铜丝
B. 硝酸钠溶液
C. 稀盐酸
D. 氢氧化钠溶液
答案:
C
9.(2024·福建改编)废金属是宝贵的资源。
(1)用废铜生产硫酸铜的过程中,涉及反应CuO + H₂SO₄ = CuSO₄ + H₂O,该反应的实验现象为黑色固体逐渐溶解,______________________________。
(2)利用废锌与含硫酸镍的废液反应回收镍,反应的化学方程式为Zn + NiSO₄ = Ni + ZnSO₄,由此判断Zn、Ni两种金属中,金属活动性较强的是________。
(3)我国科学家利用废弃金属资源,合成了催化剂(含镍、钙、铁复合金属氢氧化物),能将CO₂和电解水产生的H₂催化转化为CH₄和CO等物质,实现CO₂的捕集和应用,该反应的化学方程式为3CO₂ + 6H₂ $\stackrel{催化剂}{=\!=\!=}$ CH₄ + 2CO + 4X,其中X为_______。
(1)用废铜生产硫酸铜的过程中,涉及反应CuO + H₂SO₄ = CuSO₄ + H₂O,该反应的实验现象为黑色固体逐渐溶解,______________________________。
(2)利用废锌与含硫酸镍的废液反应回收镍,反应的化学方程式为Zn + NiSO₄ = Ni + ZnSO₄,由此判断Zn、Ni两种金属中,金属活动性较强的是________。
(3)我国科学家利用废弃金属资源,合成了催化剂(含镍、钙、铁复合金属氢氧化物),能将CO₂和电解水产生的H₂催化转化为CH₄和CO等物质,实现CO₂的捕集和应用,该反应的化学方程式为3CO₂ + 6H₂ $\stackrel{催化剂}{=\!=\!=}$ CH₄ + 2CO + 4X,其中X为_______。
答案:
(1)溶液由无色变为蓝色 (2)Zn (3)H₂O
查看更多完整答案,请扫码查看


