第27页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
8. (2024·连云港)在“测定土壤样品酸碱性”的实验中,下列装置和操作均正确的是 ( )
A. 取样
B. 溶解
C. 过滤
D. 测pH

A. 取样
B. 溶解
C. 过滤
D. 测pH
答案:
[能力进阶] 8.B
9. 下列是一些食物的近似pH,胃酸(主要成分是HCl)过多的人比较适宜吃的食物是 ( )
A. 玉米粥(pH为6.8~8.0)
B. 牛奶(pH为6.3~6.6)
C. 番茄(pH为4.0~4.4)
D. 苹果(pH为2.9~3.3)
A. 玉米粥(pH为6.8~8.0)
B. 牛奶(pH为6.3~6.6)
C. 番茄(pH为4.0~4.4)
D. 苹果(pH为2.9~3.3)
答案:
[能力进阶] 9.A
10. 溶液的pH大小与一定量溶液中所含的H⁺和OH⁻的数量有关。下列说法正确的是 ( )
A. H⁺浓度越大,pH越大
B. OH⁻浓度越大,pH越大
C. pH越小,H⁺浓度越小
D. OH⁻的质量分数越大,pH越小
A. H⁺浓度越大,pH越大
B. OH⁻浓度越大,pH越大
C. pH越小,H⁺浓度越小
D. OH⁻的质量分数越大,pH越小
答案:
[能力进阶] 10.B
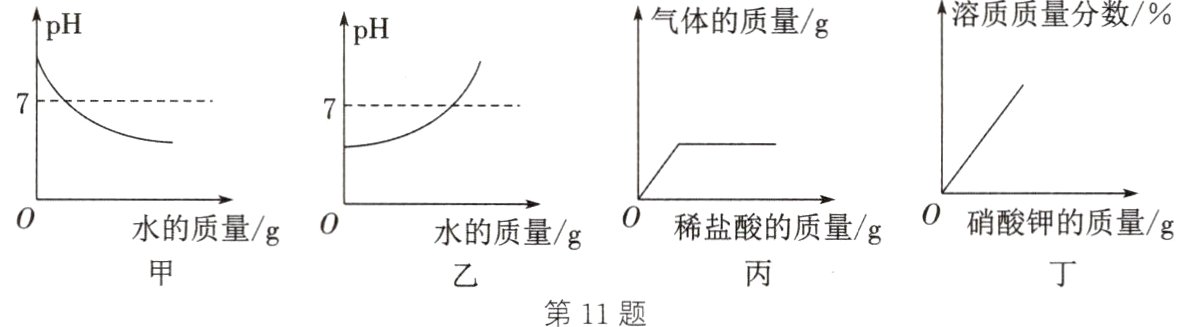
11. 下列图像中有关量的变化趋势正确的是 ( )

A. 图甲:向一定浓度的NaOH溶液中加水稀释
B. 图乙:向一定浓度的H₂SO₄溶液中加水稀释
C. 图丙:向一定质量的锌粒中加入稀盐酸
D. 图丁:向接近饱和的KNO₃溶液中加入KNO₃晶体

A. 图甲:向一定浓度的NaOH溶液中加水稀释
B. 图乙:向一定浓度的H₂SO₄溶液中加水稀释
C. 图丙:向一定质量的锌粒中加入稀盐酸
D. 图丁:向接近饱和的KNO₃溶液中加入KNO₃晶体
答案:
[能力进阶] 11.C
12. 小红同学用酸度计测得某溶液的pH为10.5,则此溶液能使紫色石蕊溶液变成_______色,无色酚酞溶液遇此溶液显_______色。要使该溶液的pH变小,我们可以采取的措施是_______(填字母,下同),要使该溶液的pH变大,我们可以采取的措施是_______。
A. 加水 B. 加pH=12的溶液 C. 加pH=5的溶液 D. 加食盐水
A. 加水 B. 加pH=12的溶液 C. 加pH=5的溶液 D. 加食盐水
答案:
[能力进阶] 12.蓝 红 ACDB
13. 经测定,在任何水溶液中,均存在一定数量的H⁺[用n(H⁺)表示]和一定数量的OH⁻[用n(OH⁻)表示],n(H⁺)与n(OH⁻)的相对大小对应溶液的酸碱性如表所示:

(1)常温下测得水的pH=7,可知水中n(H⁺)_______(填“>”“<”或“=”)n(OH⁻)。
(2)向盛有碳酸钠溶液的试管中滴入几滴酚酞溶液,现象是____________________,原因是该溶液中n(H⁺)_______(填“>”“<”或“=”)n(OH⁻)。
(3)向上述试管中再滴入适量的硫酸氢钠溶液,溶液颜色褪去,说明硫酸氢钠溶液呈_______性。

(1)常温下测得水的pH=7,可知水中n(H⁺)_______(填“>”“<”或“=”)n(OH⁻)。
(2)向盛有碳酸钠溶液的试管中滴入几滴酚酞溶液,现象是____________________,原因是该溶液中n(H⁺)_______(填“>”“<”或“=”)n(OH⁻)。
(3)向上述试管中再滴入适量的硫酸氢钠溶液,溶液颜色褪去,说明硫酸氢钠溶液呈_______性。
答案:
[拓展提优] 13.
(1)=
(2)溶液变为红色 <
(3)酸
解析:溶液的酸碱性是根据溶液中H⁺浓度与OH⁻浓度的相对大小判断。当n(H⁺)=n(OH⁻)时,溶液就呈中性;当n(H⁺)>n(OH⁻)时,溶液就呈酸性,且n(H⁺)越大,酸性越强;当n(H⁺)<n(OH⁻)时,溶液就呈碱性,且n(OH⁻)越大,碱性越强。
(1)常温下测得水的pH=7,呈中性,可知水中n(H⁺)=n(OH⁻)。
(2)向盛有碳酸钠溶液的试管中滴入几滴酚酞溶液,现象是溶液变为红色,原因是该溶液中n(H⁺)<n(OH⁻)。
(3)向上述试管中再滴入适量的硫酸氢钠溶液,溶液颜色褪去,说明碱性减弱,硫酸氢钠溶液呈酸性。
(1)=
(2)溶液变为红色 <
(3)酸
解析:溶液的酸碱性是根据溶液中H⁺浓度与OH⁻浓度的相对大小判断。当n(H⁺)=n(OH⁻)时,溶液就呈中性;当n(H⁺)>n(OH⁻)时,溶液就呈酸性,且n(H⁺)越大,酸性越强;当n(H⁺)<n(OH⁻)时,溶液就呈碱性,且n(OH⁻)越大,碱性越强。
(1)常温下测得水的pH=7,呈中性,可知水中n(H⁺)=n(OH⁻)。
(2)向盛有碳酸钠溶液的试管中滴入几滴酚酞溶液,现象是溶液变为红色,原因是该溶液中n(H⁺)<n(OH⁻)。
(3)向上述试管中再滴入适量的硫酸氢钠溶液,溶液颜色褪去,说明碱性减弱,硫酸氢钠溶液呈酸性。
查看更多完整答案,请扫码查看


