第37页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
8. 除去下列各组物质中的杂质,所用的除杂方法可行的是 ( )
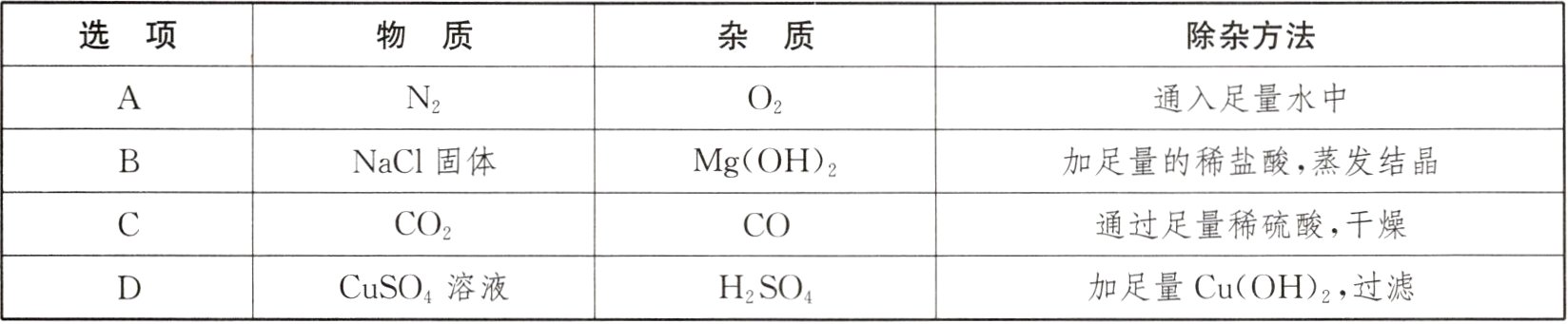

答案:
D
9. 恰好中和100 g溶质质量分数为8.0%的氢氧化钠溶液,需要100 g溶质质量分数为7.3%的稀盐酸。若将稀盐酸换成100 g溶质质量分数为7.3%的稀硫酸与其反应,则充分反应后溶液的pH ( )
A. 小于7
B. 大于7
C. 等于7
D. 无法判断
A. 小于7
B. 大于7
C. 等于7
D. 无法判断
答案:
B 解析:100g溶质质量分数为8.0%的氢氧化钠溶液与稀硫酸反应的化学方程式及其质量关系如下:
$2NaOH + H_{2}SO_{4}=Na_{2}SO_{4}+2H_{2}O$
80 98
8g 9.8g
100g溶质质量分数为7.3%的稀硫酸中硫酸质量为$100g×7.3\% = 7.3g<9.8g$,所以硫酸不足,氢氧化钠过量,反应后溶液显碱性,pH大于7,B符合题意。
$2NaOH + H_{2}SO_{4}=Na_{2}SO_{4}+2H_{2}O$
80 98
8g 9.8g
100g溶质质量分数为7.3%的稀硫酸中硫酸质量为$100g×7.3\% = 7.3g<9.8g$,所以硫酸不足,氢氧化钠过量,反应后溶液显碱性,pH大于7,B符合题意。
10. 在做酸碱中和反应的实验时,向盛有氢氧化钠溶液的烧杯中逐渐加入稀盐酸,烧杯内相关物质的质量与加入稀盐酸的质量的变化关系不正确的是 ( )
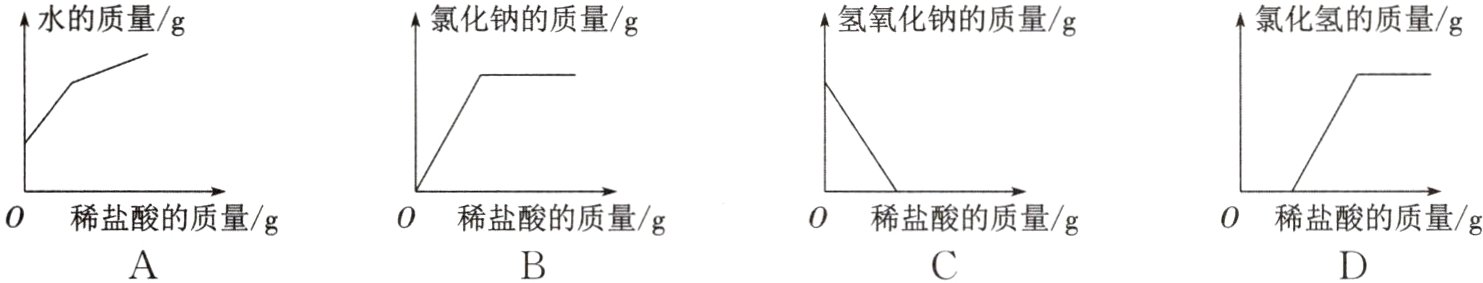

答案:
D 解析:随着反应的进行,水的质量不断增大,当恰好完全反应后,随着稀盐酸的加入,水的质量仍然不断增大,只不过增大的幅度变缓,A正确;随着反应的进行,氯化钠的质量由0不断增大,当恰好完全反应后,氯化钠质量不再变化,B正确;随着反应的进行,氢氧化钠的质量不断减小,当完全反应时氢氧化钠的质量是0,C正确;随着稀盐酸的加入,加入的稀盐酸立即与氢氧化钠反应,一段时间内溶液中氯化氢的质量是0,当稀盐酸与氢氧化钠完全反应后,随着稀盐酸的不断加入,溶液中的氯化氢质量由0不断增大,D不正确。
11. (2024·深圳)小扬同学发现染布前可以用盐酸洗去布料表面的部分碱性物质(如KOH),染色后用5%、10%、20%的醋酸溶液与等浓度、等质量的KOH溶液反应,pH变化如图。下列说法正确的是 ( )

A. KOH来源:Ca(OH)₂ + K₂CO₃ == CaCO₃↓ + KOH
B. 用盐酸清洗布料后不用水冲洗,因为盐酸没有腐蚀性
C. 由图像可知,醋酸浓度越高,所需醋酸溶液体积越大
D. 由图像可知,随着不同浓度的醋酸溶液用量的增加,pH趋近于4.0

A. KOH来源:Ca(OH)₂ + K₂CO₃ == CaCO₃↓ + KOH
B. 用盐酸清洗布料后不用水冲洗,因为盐酸没有腐蚀性
C. 由图像可知,醋酸浓度越高,所需醋酸溶液体积越大
D. 由图像可知,随着不同浓度的醋酸溶液用量的增加,pH趋近于4.0
答案:
D 解析:A选项中化学方程式未配平,应为$Ca(OH)_{2}+K_{2}CO_{3}=CaCO_{3}\downarrow +2KOH$,A选项错误。盐酸具有腐蚀性,B选项错误。如图所示,醋酸浓度越高,所需醋酸溶液体积越小,C选项错误。由图像可知,随着不同浓度的醋酸溶液用量的增加,pH趋近于4.0,D选项正确。
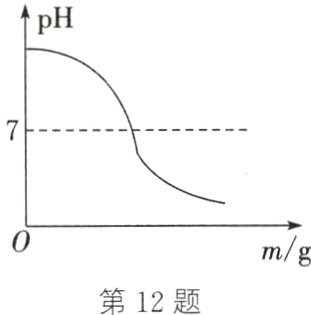
12. 如图所示是稀盐酸与40 g溶质质量分数为5%的氢氧化钠溶液反应时,溶液的pH随加入溶液的质量m的变化关系。请回答下列问题:
(1)据图分析,在实验操作过程中是往________溶液中滴加另一种溶液。
(2)当反应所得的溶液pH为4时,溶液中的溶质是__________。
(3)某同学借助无色酚酞溶液观察反应进程,当反应所得的溶液pH恰好为7时,反应掉溶质质量分数为3.65%的盐酸的质量是多少?
(1)据图分析,在实验操作过程中是往________溶液中滴加另一种溶液。
(2)当反应所得的溶液pH为4时,溶液中的溶质是__________。
(3)某同学借助无色酚酞溶液观察反应进程,当反应所得的溶液pH恰好为7时,反应掉溶质质量分数为3.65%的盐酸的质量是多少?

答案:
(1)氢氧化钠
(2)氯化钠和氯化氢
(3)解:设反应掉溶质质量分数为3.65%的盐酸的质量为$x$。
$NaOH + HCl=NaCl + H_{2}O$
40 36.5
$40g×5\%$ $3.65\%×x$
$\frac{40}{36.5}=\frac{40g×5\%}{3.65\%×x}$ $x = 50g$
答:反应掉溶质质量分数为3.65%的盐酸的质量为50g。
解析:
(1)从图中可以看出pH随另一种溶液的滴加而变小,所以是向氢氧化钠溶液中滴加稀盐酸。
(2)pH为4时,溶液呈酸性,盐酸过量,故溶液中的溶质为氯化钠和氯化氢。
(1)氢氧化钠
(2)氯化钠和氯化氢
(3)解:设反应掉溶质质量分数为3.65%的盐酸的质量为$x$。
$NaOH + HCl=NaCl + H_{2}O$
40 36.5
$40g×5\%$ $3.65\%×x$
$\frac{40}{36.5}=\frac{40g×5\%}{3.65\%×x}$ $x = 50g$
答:反应掉溶质质量分数为3.65%的盐酸的质量为50g。
解析:
(1)从图中可以看出pH随另一种溶液的滴加而变小,所以是向氢氧化钠溶液中滴加稀盐酸。
(2)pH为4时,溶液呈酸性,盐酸过量,故溶液中的溶质为氯化钠和氯化氢。
查看更多完整答案,请扫码查看


