第35页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
9. 冬春季节,园林工人会给许多树的树干刷一段石灰浆。下列有关说法正确的是 ( )
A. 石灰浆属于溶液
B. 石灰浆的主要成分是CaO
C. 石灰浆可以防止树木上的害虫生卵
D. 一段时间后树干上的白色物质是Ca(OH)₂
A. 石灰浆属于溶液
B. 石灰浆的主要成分是CaO
C. 石灰浆可以防止树木上的害虫生卵
D. 一段时间后树干上的白色物质是Ca(OH)₂
答案:
9.C
10. 将22 g硝酸铁和硝酸铜的混合物完全溶于水中配制成100 g溶液,测得该溶液中氮元素的质量分数为3.5%,向其中加入一定量的氢氧化钾溶液,待铁离子和铜离子完全沉淀后过滤、洗涤、干燥,所得固体的质量为 ( )
A. 10 g
B. 10.75 g
C. 11.25 g
D. 12 g
A. 10 g
B. 10.75 g
C. 11.25 g
D. 12 g
答案:
10.B 解析:该溶液中氮元素的质量分数为3.5%,则100g该溶液中氮元素的质量为100g×3.5%=3.5g,其中硝酸根离子的质量为$\frac{3.5\ g}{\frac{14}{62}\times100\%}=15.5\ g$,则该溶液中含铁离子和铜离子的总质量为22g - 15.5g = 6.5g。硝酸铁和硝酸铜与氢氧化钾反应生成氢氧化铁和氢氧化铜,设生成氢氧化物时,设其中含有氢氧根离子的质量为x,则:
$NO_{3}^{-}\sim OH^{-}$
62 17
15.5g x
$\frac{62}{17}=\frac{15.5\ g}{x}$ $x = 4.25\ g$
所以所得固体(氢氧化物)的质量为6.5g + 4.25g = 10.75g。
$NO_{3}^{-}\sim OH^{-}$
62 17
15.5g x
$\frac{62}{17}=\frac{15.5\ g}{x}$ $x = 4.25\ g$
所以所得固体(氢氧化物)的质量为6.5g + 4.25g = 10.75g。
11. SO₂是一种有毒气体,与CO₂的化学性质相似,能与水和碱反应。某化学兴趣小组同学为了比较室温下饱和石灰水、饱和氢氧化钠溶液吸收SO₂的效果,设计了如图Ⅰ所示的实验,测得烧瓶内压强与时间的关系曲线如图Ⅱ所示。(已知:装置甲、乙、丙中注射器内的试剂分别是水、饱和石灰水、饱和氢氧化钠溶液,烧瓶内SO₂的体积相同)

(1)写出装置甲中反应的化学方程式:______________________________。
(2)图Ⅱ中烧瓶内气体压强均是先增大后减小,气体压强先增大的原因是____________________。
(3)分析图Ⅱ中乙、丙两条曲线,可以得出结论:______________________________。

(1)写出装置甲中反应的化学方程式:______________________________。
(2)图Ⅱ中烧瓶内气体压强均是先增大后减小,气体压强先增大的原因是____________________。
(3)分析图Ⅱ中乙、丙两条曲线,可以得出结论:______________________________。
答案:
11.
(1) $SO_{2} + H_{2}O = H_{2}SO_{3}$
(2) 加入的液体占据了部分体积,压缩了瓶内气体,使瓶内的气体压强先增大
(3) 室温下,饱和氢氧化钠溶液比饱和石灰水吸收二氧化硫的效果更好(合理答案均可)
(1) $SO_{2} + H_{2}O = H_{2}SO_{3}$
(2) 加入的液体占据了部分体积,压缩了瓶内气体,使瓶内的气体压强先增大
(3) 室温下,饱和氢氧化钠溶液比饱和石灰水吸收二氧化硫的效果更好(合理答案均可)
12. 向100 g CuSO₄溶液中滴加NaOH溶液,生成沉淀的质量与加入NaOH溶液的质量之间的关系如图所示。请依据图中信息回答下列问题:
(1)该反应生成的沉淀的质量为________g。
(2)求CuSO₄溶液中溶质的质量分数。
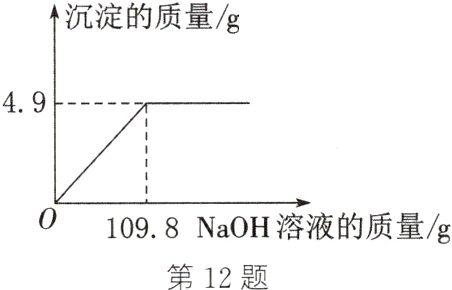
(1)该反应生成的沉淀的质量为________g。
(2)求CuSO₄溶液中溶质的质量分数。

答案:
12.
(1)4.9
(2)解:设100g硫酸铜溶液中硫酸铜的质量为x。
$CuSO_{4} + 2NaOH = Na_{2}SO_{4} + Cu(OH)_{2}\downarrow$
160 98
x 4.9g
$\frac{160}{98}=\frac{x}{4.9\ g}$ $x = 8\ g$
该硫酸铜溶液中溶质的质量分数为$\frac{8\ g}{100\ g}\times100\% = 8\%$。
答:硫酸铜溶液中溶质的质量分数为8%。
(1)4.9
(2)解:设100g硫酸铜溶液中硫酸铜的质量为x。
$CuSO_{4} + 2NaOH = Na_{2}SO_{4} + Cu(OH)_{2}\downarrow$
160 98
x 4.9g
$\frac{160}{98}=\frac{x}{4.9\ g}$ $x = 8\ g$
该硫酸铜溶液中溶质的质量分数为$\frac{8\ g}{100\ g}\times100\% = 8\%$。
答:硫酸铜溶液中溶质的质量分数为8%。
查看更多完整答案,请扫码查看


