第17页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
7. t℃时,把50g硝酸钠放入50g水中,使其充分溶解(t℃时,硝酸钠的溶解度为88g)。下列关于所得溶液的说法错误的是 ( )
A. 该溶液是饱和溶液
B. 溶液中Na⁺和NO₃⁻的个数一定相等
C. 溶液质量为100g
D. 溶质与溶剂的质量比为22∶25
A. 该溶液是饱和溶液
B. 溶液中Na⁺和NO₃⁻的个数一定相等
C. 溶液质量为100g
D. 溶质与溶剂的质量比为22∶25
答案:
C 解析:$t\degree C$时,硝酸钠的溶解度为88 g,则50 g水中最多能溶解44 g硝酸钠,故把50 g硝酸钠放入50 g水中,所得溶液为饱和溶液,A正确。溶液质量为50 g + 44 g = 94 g,C错误。溶质与溶剂的质量比为44 g : 50 g = 22 : 25,D正确。根据$NaNO_{3}$中$Na^{+}$和$NO_{3}^{-}$的个数比为1 : 1可知,溶液中$Na^{+}$和$NO_{3}^{-}$的个数一定相等,B正确。
8. (2024·连云港)我国盐湖地区有“夏天晒盐(NaCl),冬天捞碱(Na₂CO₃)”的做法。NaCl、Na₂CO₃的溶解度曲线如图所示。下列说法中正确的是( )
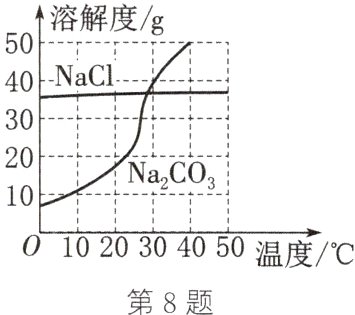
A. 20℃时,Na₂CO₃的饱和溶液升温到40℃,仍是饱和溶液
B. 30℃时,在100g水中加入40g NaCl,形成不饱和溶液
C. NaCl的溶解度比Na₂CO₃的大
D. “夏天晒盐”经过蒸发结晶过程,“冬天捞碱”经过降温结晶过程

A. 20℃时,Na₂CO₃的饱和溶液升温到40℃,仍是饱和溶液
B. 30℃时,在100g水中加入40g NaCl,形成不饱和溶液
C. NaCl的溶解度比Na₂CO₃的大
D. “夏天晒盐”经过蒸发结晶过程,“冬天捞碱”经过降温结晶过程
答案:
D 解析:20 $\degree C$时,$Na_{2}CO_{3}$的饱和溶液升温到40 $\degree C$,溶解度变大,变为不饱和溶液,A错误。由溶解度曲线可知,30 $\degree C$时,$NaCl$的溶解度小于40 g,即在该温度下,100 g水中溶解不了40 g $NaCl$,所以30 $\degree C$时,在100 g水中加入40 g $NaCl$,形成饱和溶液,B错误。比较溶解度大小必须有温度限制,C错误。“夏天晒盐”是因为氯化钠的溶解度受温度变化影响较小,经过蒸发结晶析出氯化钠;“冬天捞碱”是因为碳酸钠的溶解度受温度变化影响较大,经过降温结晶析出碳酸钠,D正确。
9. 保持t℃,某溶液(仅含一种溶质)蒸发掉10g水,析出了2g晶体,再蒸发掉10g水,析出了3g晶体,则该溶质在t℃时的溶解度是________。
答案:
30 g 解析:第一次恒温蒸发掉10 g水,析出了2 g晶体,则析出晶体后的溶液为饱和溶液,再恒温蒸发掉10 g水,析出了3 g晶体,说明$t\degree C$时,饱和溶液蒸发10 g水析出了3 g晶体。固体物质的溶解度是指在一定温度下,该物质在100 g溶剂里达到饱和状态所溶解的质量,则该溶质在$t\degree C$时的溶解度是$3\ g×\frac{100\ g}{10\ g} = 30\ g$。
10. (2024·广西)《天工开物》记载“凡引水种盐……南风大起,则一宵结成,名曰颗盐”,表明古人已经掌握了制盐工艺。回答下列问题:
(1)古人的制盐工艺属于________(填“物理”或“化学”)变化。该工艺获得的“颗盐”属于________(填“混合物”或“纯净物”)。
(2)用化学知识能很好地解释古人的制盐工艺。如图为氯化钠的溶解度曲线。20℃时氯化钠的溶解度为________g;此温度下,将9g氯化钠溶解到25g水中,可配得氯化钠的________(填“饱和”或“不饱和”)溶液;保持温度不变,蒸发部分溶剂,该溶液的溶质质量分数________(填“变大”“变小”或“不变”)。
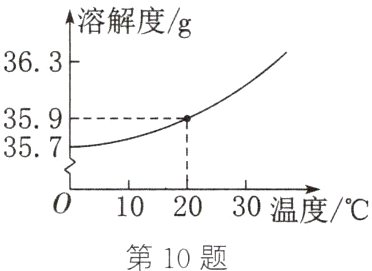
(1)古人的制盐工艺属于________(填“物理”或“化学”)变化。该工艺获得的“颗盐”属于________(填“混合物”或“纯净物”)。
(2)用化学知识能很好地解释古人的制盐工艺。如图为氯化钠的溶解度曲线。20℃时氯化钠的溶解度为________g;此温度下,将9g氯化钠溶解到25g水中,可配得氯化钠的________(填“饱和”或“不饱和”)溶液;保持温度不变,蒸发部分溶剂,该溶液的溶质质量分数________(填“变大”“变小”或“不变”)。

答案:
(1) 物理 混合物
(2) 35.9 饱和 不变
(1) 物理 混合物
(2) 35.9 饱和 不变
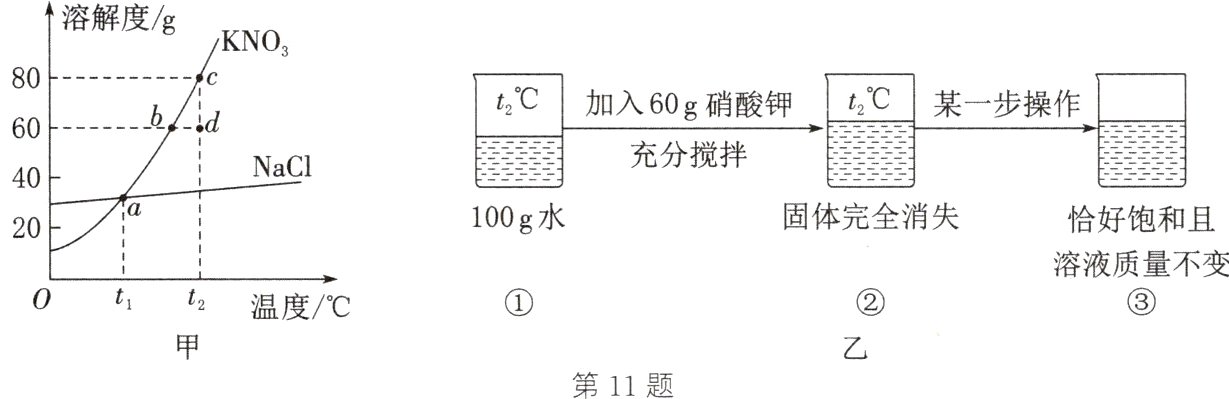
11. 图甲为KNO₃和NaCl两种固体的溶解度曲线。请回答下列问题:
(1)a点处KNO₃和NaCl两种溶液中溶质的质量分数________(填“相等”或“不相等”)。
(2)c点处KNO₃溶液中溶质的质量分数为________(结果精确到0.1%);d点处的KNO₃溶液________(填“是”或“不是”)饱和溶液。
(3)图乙中“某一步操作”前后的溶液状态变化过程可以在图甲表示为________(填字母)。
A. d点→c点
B. d点→b点
C. c点→b点
D. c点→d点
(1)a点处KNO₃和NaCl两种溶液中溶质的质量分数________(填“相等”或“不相等”)。
(2)c点处KNO₃溶液中溶质的质量分数为________(结果精确到0.1%);d点处的KNO₃溶液________(填“是”或“不是”)饱和溶液。
(3)图乙中“某一步操作”前后的溶液状态变化过程可以在图甲表示为________(填字母)。
A. d点→c点
B. d点→b点
C. c点→b点
D. c点→d点

答案:
(1) 相等
(2) 44.4% 不是
(3) B
解析:
(1) $a$点处$KNO_{3}$和$NaCl$两种物质的溶解度相等,并且都是饱和溶液,所以溶液中溶质的质量分数相等。
(2) $c$点处是硝酸钾在$t_{2}\degree C$时的饱和溶液,溶解度是80 g,$KNO_{3}$溶液中溶质的质量分数为$\frac{80\ g}{100\ g + 80\ g}×100\%≈44.4\%$;$d$点处的$KNO_{3}$溶液不是饱和溶液。
(3) 图乙中“某一步操作”前后的溶液状态变化过程可以在图甲表示为$d$点→$b$点(降低温度),因为该操作将不饱和溶液变成恰好饱和溶液且溶液质量不变。
(1) 相等
(2) 44.4% 不是
(3) B
解析:
(1) $a$点处$KNO_{3}$和$NaCl$两种物质的溶解度相等,并且都是饱和溶液,所以溶液中溶质的质量分数相等。
(2) $c$点处是硝酸钾在$t_{2}\degree C$时的饱和溶液,溶解度是80 g,$KNO_{3}$溶液中溶质的质量分数为$\frac{80\ g}{100\ g + 80\ g}×100\%≈44.4\%$;$d$点处的$KNO_{3}$溶液不是饱和溶液。
(3) 图乙中“某一步操作”前后的溶液状态变化过程可以在图甲表示为$d$点→$b$点(降低温度),因为该操作将不饱和溶液变成恰好饱和溶液且溶液质量不变。
查看更多完整答案,请扫码查看


