第43页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
8. 侯氏制碱法的原理为$NaCl + H_2O + NH_3 + CO_2 = NaHCO_3\downarrow + NH_4Cl$。下列说法不正确的是 ( )
A. 氯化铵属于盐
B. 反应后溶液中不含碳酸氢钠
C. 常温下,$NaCl$溶液的pH=7
D. 该反应消耗$CO_2$,体现“碳中和”
A. 氯化铵属于盐
B. 反应后溶液中不含碳酸氢钠
C. 常温下,$NaCl$溶液的pH=7
D. 该反应消耗$CO_2$,体现“碳中和”
答案:
B
9. 取一定质量的$CaCO_3$固体高温加热一段时间后,冷却,测得剩余固体的质量为8.0 g,其中钙元素的质量分数为50.0%。下列判断正确的是 ( )
A. 原来$CaCO_3$的质量为14.5 g
B. 生成2.0 g $CO_2$气体
C. 剩余8.0 g固体为纯净物
D. 向剩余8.0 g固体中加入盐酸,没有气泡产生
A. 原来$CaCO_3$的质量为14.5 g
B. 生成2.0 g $CO_2$气体
C. 剩余8.0 g固体为纯净物
D. 向剩余8.0 g固体中加入盐酸,没有气泡产生
答案:
B解析:根据题意可知,钙元素的质量为 $ 8.0g\times50.0\% = 4.0g $,所以反应前碳酸钙的质量为 $ \frac{4.0g}{\frac{40}{100}\times100\%}=10.0g $,A错误。根据质量守恒定律可知,生成二氧化碳的质量为 $ 10.0g - 8.0g = 2.0g $,B正确。设10.0g碳酸钙完全分解生成二氧化碳的质量为x。
$ CaCO_{3}\stackrel{高温}{=}CaO + CO_{2}\uparrow $
100 44
10.0g x
$ \frac{100}{44}=\frac{10.0g}{x} $ $ x = 4.4g $
4.4g>2.0g,所以10.0g碳酸钙没有完全分解,剩余8.0g固体中有碳酸钙和氧化钙,为混合物,C错误。剩余8.0g固体为氧化钙和碳酸钙的混合物,加入盐酸会产生气泡,D错误。
$ CaCO_{3}\stackrel{高温}{=}CaO + CO_{2}\uparrow $
100 44
10.0g x
$ \frac{100}{44}=\frac{10.0g}{x} $ $ x = 4.4g $
4.4g>2.0g,所以10.0g碳酸钙没有完全分解,剩余8.0g固体中有碳酸钙和氧化钙,为混合物,C错误。剩余8.0g固体为氧化钙和碳酸钙的混合物,加入盐酸会产生气泡,D错误。
10. (2024·齐齐哈尔改编)现有一包白色粉末,可能含有碳酸钠、碳酸氢钠、碳酸钾、硫酸铜、氯化钠中的一种或几种。为确定其成分,某化学小组同学取10.6 g该白色粉末于烧杯中,加入100 g稀盐酸,恰好完全反应,产生4.4 g气体,并得到无色溶液。下列说法正确的是 ( )
A. 该白色粉末中一定含有硫酸铜
B. 所用稀盐酸中溶质的质量分数不小于7.3%
C. 该白色粉末可能由碳酸钠、氯化钠和碳酸钾组成
D. 若该白色粉末中只含两种物质,则该白色粉末的组成最多有两种情况
A. 该白色粉末中一定含有硫酸铜
B. 所用稀盐酸中溶质的质量分数不小于7.3%
C. 该白色粉末可能由碳酸钠、氯化钠和碳酸钾组成
D. 若该白色粉末中只含两种物质,则该白色粉末的组成最多有两种情况
答案:
D解析:白色粉末中可能含有碳酸钠、碳酸氢钠、碳酸钾、硫酸铜、氯化钠中的一种或几种,取10.6g该白色粉末于烧杯中,加入100g稀盐酸,恰好完全反应,产生4.4g气体,并得到无色溶液,硫酸铜溶液呈蓝色,则该白色粉末中一定不含硫酸铜,A 不正确。碳酸钠和盐酸反应的化学方程式及其质量关系如下:
$ Na_{2}CO_{3}+2HCl = 2NaCl + H_{2}O + CO_{2}\uparrow $
106 73 44
10.6g 7.3g 4.4g
即10.6g碳酸钠和7.3g氯化氢完全反应生成4.4g二氧化碳;碳酸氢钠和盐酸反应的化学方程式及其质量关系如下:
$ NaHCO_{3}+HCl = NaCl + H_{2}O + CO_{2}\uparrow $
84 36.5 44
8.4g 3.65g 4.4g
即8.4g碳酸氢钠和3.65g氯化氢完全反应生成4.4g二氧化碳;碳酸钾和盐酸反应的化学方程式及其质量关系如下:
$ K_{2}CO_{3}+2HCl = 2KCl + H_{2}O + CO_{2}\uparrow $
138 73 44
13.8g 7.3g 4.4g
即13.8g碳酸钾和7.3g氯化氢完全反应生成4.4g二氧化碳。若该白色粉末是碳酸氢钠和氯化钠的混合物,产生4.4g二氧化碳只需要3.65g氯化氢,此时所用稀盐酸中溶质的质量分数为 $ \frac{3.65g}{100g}\times100\% = 3.65\%<7.3\% $,B不正确。由分析可知,10.6g碳酸钠完全反应生成4.4g二氧化碳,13.8g碳酸钾完全反应生成4.4g二氧化碳,氯化钠不能和盐酸反应,若该白色粉末由碳酸钠、氯化钠和碳酸钾组成,则生成的气体质量会小于4.4g,与题意不符,C不正确。若该白色粉末中只含两种物质,则该白色粉末的组成可以是①碳酸氢钠、碳酸钾,②碳酸氢钠、氯化钠,最多有两种情况,D正确。
$ Na_{2}CO_{3}+2HCl = 2NaCl + H_{2}O + CO_{2}\uparrow $
106 73 44
10.6g 7.3g 4.4g
即10.6g碳酸钠和7.3g氯化氢完全反应生成4.4g二氧化碳;碳酸氢钠和盐酸反应的化学方程式及其质量关系如下:
$ NaHCO_{3}+HCl = NaCl + H_{2}O + CO_{2}\uparrow $
84 36.5 44
8.4g 3.65g 4.4g
即8.4g碳酸氢钠和3.65g氯化氢完全反应生成4.4g二氧化碳;碳酸钾和盐酸反应的化学方程式及其质量关系如下:
$ K_{2}CO_{3}+2HCl = 2KCl + H_{2}O + CO_{2}\uparrow $
138 73 44
13.8g 7.3g 4.4g
即13.8g碳酸钾和7.3g氯化氢完全反应生成4.4g二氧化碳。若该白色粉末是碳酸氢钠和氯化钠的混合物,产生4.4g二氧化碳只需要3.65g氯化氢,此时所用稀盐酸中溶质的质量分数为 $ \frac{3.65g}{100g}\times100\% = 3.65\%<7.3\% $,B不正确。由分析可知,10.6g碳酸钠完全反应生成4.4g二氧化碳,13.8g碳酸钾完全反应生成4.4g二氧化碳,氯化钠不能和盐酸反应,若该白色粉末由碳酸钠、氯化钠和碳酸钾组成,则生成的气体质量会小于4.4g,与题意不符,C不正确。若该白色粉末中只含两种物质,则该白色粉末的组成可以是①碳酸氢钠、碳酸钾,②碳酸氢钠、氯化钠,最多有两种情况,D正确。
11. (2024·安徽)碳酸锂($Li_2CO_3$)是制备新能源汽车电池的重要原料。我国盐湖卤水中主要含有氯化锂、氯化钠、硫酸镁等溶质,一种以化学沉淀法从卤水中生产碳酸锂的工艺如图所示。

(1)步骤①发生反应的化学方程式为__________________________。
(2)步骤②中操作a的名称是________。
(3)步骤③中加入草酸钠,其中草酸根($C_2O_4^{2-}$)的化合价为 - 2,则草酸钠的化学式为_______。
(4)滤液2中含有LiCl,则步骤④中生成$Li_2CO_3$的基本反应类型是____________。
(5)该工艺中用到的氧化物有_______(写一种即可)。

(1)步骤①发生反应的化学方程式为__________________________。
(2)步骤②中操作a的名称是________。
(3)步骤③中加入草酸钠,其中草酸根($C_2O_4^{2-}$)的化合价为 - 2,则草酸钠的化学式为_______。
(4)滤液2中含有LiCl,则步骤④中生成$Li_2CO_3$的基本反应类型是____________。
(5)该工艺中用到的氧化物有_______(写一种即可)。
答案:
(1) $ CaO + H_{2}O = Ca(OH)_{2} $
(2) 过滤
(3) $ Na_{2}C_{2}O_{4} $
(4) 复分解反应
(5) 氧化钙(或水)
(1) $ CaO + H_{2}O = Ca(OH)_{2} $
(2) 过滤
(3) $ Na_{2}C_{2}O_{4} $
(4) 复分解反应
(5) 氧化钙(或水)
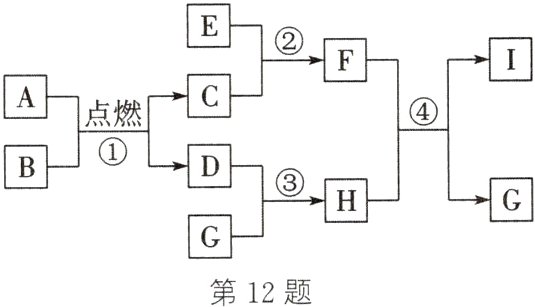
12. (2024·临夏)A~I是初中化学常见的物质,它们之间的相互转化关系如图所示(部分生成物及反应条件已略去,假设每步反应均恰好完全反应)。已知A为酒精,G俗称苛性钠,I为石灰石的主要成分。
(1)I的化学式是_______。
(2)反应②的化学方程式为____________________,写出F的一种用途:____________。
(3)写出反应③的化学方程式:____________________。
(4)反应④的基本反应类型为__________。
(1)I的化学式是_______。
(2)反应②的化学方程式为____________________,写出F的一种用途:____________。
(3)写出反应③的化学方程式:____________________。
(4)反应④的基本反应类型为__________。

答案:
(1) $ CaCO_{3} $
(2) $ CaO + H_{2}O = Ca(OH)_{2} $ 改良酸性土壤
(3) $ CO_{2}+2NaOH = Na_{2}CO_{3}+H_{2}O $
(4) 复分解反应 解析:A~I是初中化学常见的物质。A为酒精;G俗称苛性钠,则G是氢氧化钠;I为石灰石的主要成分,则I 是碳酸钙;酒精和氧气完全燃烧生成水和二氧化碳,二氧化碳能和氢氧化钠反应,则B是氧气,C是水,D是二氧化碳;二氧化碳和氢氧化钠反应生成H,水和E反应生成F,F和H反应生成碳酸钙和氢氧化钠,则E是氧化钙,F是氢氧化钙,H是碳酸钠。
(1) $ CaCO_{3} $
(2) $ CaO + H_{2}O = Ca(OH)_{2} $ 改良酸性土壤
(3) $ CO_{2}+2NaOH = Na_{2}CO_{3}+H_{2}O $
(4) 复分解反应 解析:A~I是初中化学常见的物质。A为酒精;G俗称苛性钠,则G是氢氧化钠;I为石灰石的主要成分,则I 是碳酸钙;酒精和氧气完全燃烧生成水和二氧化碳,二氧化碳能和氢氧化钠反应,则B是氧气,C是水,D是二氧化碳;二氧化碳和氢氧化钠反应生成H,水和E反应生成F,F和H反应生成碳酸钙和氢氧化钠,则E是氧化钙,F是氢氧化钙,H是碳酸钠。
查看更多完整答案,请扫码查看


