第29页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
8. 取一定质量的锌粒和铜片于同一敞口容器中,再逐渐加入稀硫酸,下列为加入稀硫酸的质量与有关量的变化关系,其中正确的是 ( )
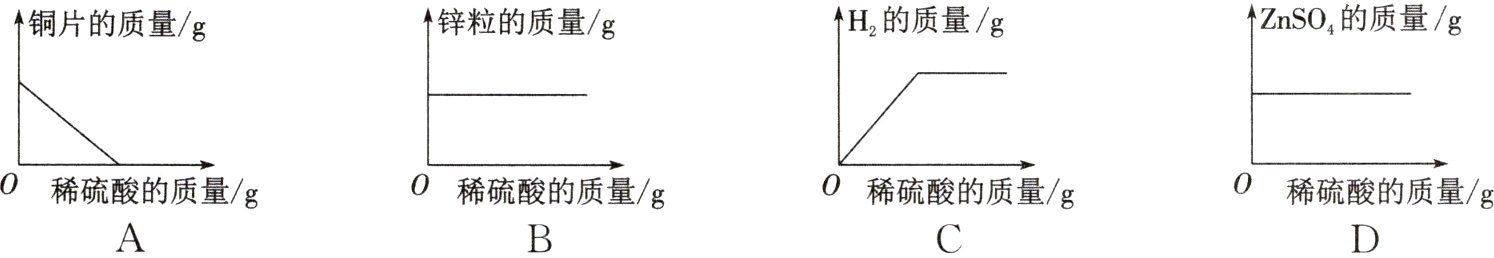

答案:
C 解析:铜与稀硫酸不反应,随着稀硫酸的加入,铜片的质量不变,A选项错误。锌和稀硫酸反应生成硫酸锌和氢气,随着稀硫酸的加入,锌粒的质量不断减少至0,B选项错误。锌和稀硫酸反应生成硫酸锌和氢气,随着稀硫酸的不断加入,氢气的质量不断增加,当锌完全消耗,氢气的质量不变,C选项正确。锌和稀硫酸反应生成硫酸锌和氢气,随着稀硫酸的不断加入,硫酸锌的质量不断增加,当锌完全消耗,硫酸锌的质量不变,D选项错误。
9. 把100 g一定溶质质量分数的稀盐酸平均分成两份,分别加入两只相同的烧杯中,放在已调平的天平左、右两盘上,此时天平平衡,然后在左盘烧杯中加入5.6 g铁粉。下列有关说法正确的是 ( )
A. 若在右盘烧杯中加入5.6 g锌粉,反应停止后,天平不可能平衡
B. 若在右盘烧杯中加入5.6 g黄铜粉,反应停止后,天平不可能平衡
C. 在右盘烧杯中加入5.6 g镁粉,反应停止后,若天平平衡,则稀盐酸的溶质质量分数不大于7.3%
D. 在右盘烧杯中加入5.6 g铝粉,反应停止后,若天平不平衡,则左、右两盘烧杯中的金属一定都无剩余
A. 若在右盘烧杯中加入5.6 g锌粉,反应停止后,天平不可能平衡
B. 若在右盘烧杯中加入5.6 g黄铜粉,反应停止后,天平不可能平衡
C. 在右盘烧杯中加入5.6 g镁粉,反应停止后,若天平平衡,则稀盐酸的溶质质量分数不大于7.3%
D. 在右盘烧杯中加入5.6 g铝粉,反应停止后,若天平不平衡,则左、右两盘烧杯中的金属一定都无剩余
答案:
C 解析:在右盘烧杯中加入5.6 g锌粉,若金属均过量,酸不足,酸完全反应,生成氢气的质量相等,则反应停止后,天平平衡,A说法错误。在右盘烧杯中加入5.6 g黄铜粉,黄铜粉是铜锌合金,若铁、锌均过量,酸不足,酸完全反应,生成氢气的质量相等,则反应停止后,天平平衡,B说法错误。在右盘烧杯中加入5.6 g镁粉,反应停止后,若天平平衡,说明生成氢气的质量相等,由化学方程式:Mg+2HCl $\xlongequal[\space \space ]{\space \space }$ MgCl₂+H₂↑、Fe+2HCl $\xlongequal[\space \space ]{\space \space }$ FeCl₂+H₂↑可知,生成相同质量的氢气,消耗铁的质量更大,当铁恰好与稀盐酸完全反应时,稀盐酸的溶质质量分数最大,设铁恰好与稀盐酸完全反应时,稀盐酸的溶质质量分数为x。
Fe + 2HCl $\xlongequal[\space \space ]{\space \space }$ FeCl₂+H₂↑
56 73
5.6 g 100 g×x
$\frac{56}{73}=\frac{5.6 g}{100 g×x}$ x=7.3%
所以反应停止后,若天平平衡,则稀盐酸的溶质质量分数不大于7.3%,C说法正确。在右盘烧杯中加入5.6 g铝粉,如果金属完全反应,铝和稀盐酸反应:
2Al + 6HCl $\xlongequal[\space \space ]{\space \space }$ 2AlCl₃+ 3H₂↑
54 219 6
5.6 g 约22.7 g 约0.62 g
铁和稀盐酸反应:
Fe +2HCl $\xlongequal[\space \space ]{\space \space }$ FeCl₂ + H₂↑
56 73 2
5.6 g 7.3 g 0.2 g
反应停止后,若天平不平衡,说明生成氢气的质量不相等,则两种金属可能完全反应,也可能铁完全反应,铝有剩余(酸中的溶质质量大于7.3 g,小于22.7 g),D说法错误。
Fe + 2HCl $\xlongequal[\space \space ]{\space \space }$ FeCl₂+H₂↑
56 73
5.6 g 100 g×x
$\frac{56}{73}=\frac{5.6 g}{100 g×x}$ x=7.3%
所以反应停止后,若天平平衡,则稀盐酸的溶质质量分数不大于7.3%,C说法正确。在右盘烧杯中加入5.6 g铝粉,如果金属完全反应,铝和稀盐酸反应:
2Al + 6HCl $\xlongequal[\space \space ]{\space \space }$ 2AlCl₃+ 3H₂↑
54 219 6
5.6 g 约22.7 g 约0.62 g
铁和稀盐酸反应:
Fe +2HCl $\xlongequal[\space \space ]{\space \space }$ FeCl₂ + H₂↑
56 73 2
5.6 g 7.3 g 0.2 g
反应停止后,若天平不平衡,说明生成氢气的质量不相等,则两种金属可能完全反应,也可能铁完全反应,铝有剩余(酸中的溶质质量大于7.3 g,小于22.7 g),D说法错误。
10. (2024·河北)为测定某稀硫酸中溶质的质量分数,向盛有100 g该稀硫酸的烧杯中分三次加入一定质量的锌粉,生成气体的质量与加入锌粉质量的关系如图所示。请计算:
(1)m的值为_______。
(2)该稀硫酸中溶质的质量分数。
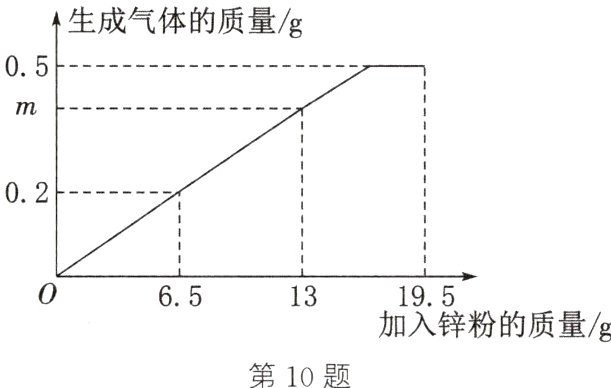
(1)m的值为_______。
(2)该稀硫酸中溶质的质量分数。

答案:
(1)0.4 (2)解:设稀硫酸中溶质的质量分数为x。
Zn+ H₂SO₄ $\xlongequal[\space \space ]{\space \space }$ ZnSO₄ + H₂↑
98 2
100 g×x 0.5 g
$\frac{98}{2}=\frac{100 g×x}{0.5 g}$ x=24.5%
答:该稀硫酸中溶质的质量分数为24.5%。
解析:(1)由图像可得,6.5 g锌完全反应生成0.2 g氢气,锌的质量大于13 g时,硫酸消耗完,说明13 g锌完全反应,因此m g=0.2 g×$\frac{13 g}{6.5 g}$=0.4 g,即m=0.4。
Zn+ H₂SO₄ $\xlongequal[\space \space ]{\space \space }$ ZnSO₄ + H₂↑
98 2
100 g×x 0.5 g
$\frac{98}{2}=\frac{100 g×x}{0.5 g}$ x=24.5%
答:该稀硫酸中溶质的质量分数为24.5%。
解析:(1)由图像可得,6.5 g锌完全反应生成0.2 g氢气,锌的质量大于13 g时,硫酸消耗完,说明13 g锌完全反应,因此m g=0.2 g×$\frac{13 g}{6.5 g}$=0.4 g,即m=0.4。
11. (2024·牡丹江)将6 g某合金样品放入烧杯中,向其中加入100 g稀盐酸恰好完全反应,烧杯中剩余物的总质量是105.8 g,该合金样品可能是_______(填字母)。
A. Cu、Zn合金 B. Fe、C合金
C. Mg、Al合金 D. Mg、Cu、Al合金
A. Cu、Zn合金 B. Fe、C合金
C. Mg、Al合金 D. Mg、Cu、Al合金
答案:
BD 解析:生成氢气的质量为6 g+100 g-105.8 g=0.2 g。铜和稀盐酸不反应,锌和稀盐酸反应生成氯化锌和氢气,由Zn+2HCl $\xlongequal[\space \space ]{\space \space }$ ZnCl₂+H₂↑可知,参加反应的锌和生成氢气的质量比是65∶2,则生成0.2 g氢气,消耗锌的质量为6.5 g,大于6 g,A选项错误。碳和稀盐酸不反应,铁和稀盐酸反应生成氯化亚铁和氢气,生成0.2 g氢气,消耗铁的质量为5.6 g,小于6 g,则该合金样品可能是Fe、C合金,B选项正确。由Mg+2HCl $\xlongequal[\space \space ]{\space \space }$ MgCl₂+H₂↑可知,参加反应的镁和生成氢气的质量比是24∶2,则生成0.2 g氢气,消耗的镁的质量为2.4 g;由2Al+6HCl $\xlongequal[\space \space ]{\space \space }$ 2AlCl₃+3H₂↑可知,参加反应的铝和生成氢气的质量比是54∶6=9∶1,则生成0.2 g氢气,消耗铝的质量为1.8 g;则Mg、Al合金与稀盐酸恰好完全反应,生成0.2 g氢气,消耗的合金质量一定小于6 g,C选项错误。根据C选项的分析,Mg、Al合金与稀盐酸恰好完全反应,生成0.2 g氢气,消耗的合金的质量一定小于6 g,铜和稀盐酸不反应,则合金样品可能是Mg、Cu、Al合金,D选项正确。
查看更多完整答案,请扫码查看


