第31页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
9. 取等质量、等溶质质量分数的稀盐酸于两只烧杯中,将它们分别放在托盘天平的左、右两盘,天平平衡,在左盘烧杯中加入10 g CaCO₃,恰好完全反应,若要使天平重新平衡,则右盘烧杯中加入的物质可以是 ( )
A. 5.6 g铁和锌
B. 10 g镁和氧化镁
C. 10 g碳酸镁
D. 10 g碳酸钠和碳酸锌
A. 5.6 g铁和锌
B. 10 g镁和氧化镁
C. 10 g碳酸镁
D. 10 g碳酸钠和碳酸锌
答案:
C解析:设10g碳酸钙完全反应生成二氧化碳的质量为x。
$CaCO_{3}+2HCl\xlongequal{\;\;}CaCl_{2}+H_{2}O+CO_{2}\uparrow$
100 44
10g x
$\frac{100}{44}=\frac{10g}{x}$ $x = 4.4g$
左盘增加的质量是10g−4.4g=5.6g,右盘增加的质量也应为5.6g,托盘天平才能保持平衡。因碳酸钙与盐酸恰好完全反应,所以可计算出消耗的溶质HCl的质量为7.3g。5.6g铁和锌的混合物与稀盐酸反应产生氢气,从而使右盘增加的质量小于5.6g,A不符合题意。假设10g物质全部是镁,设生成氢气的质量是a。
$Mg + 2HCl\xlongequal{\;\;}MgCl_{2}+H_{2}\uparrow$
24 2
10g a
$\frac{24}{2}=\frac{10g}{a}$ $a\approx0.83g$
氧化镁与盐酸反应生成氯化镁和水,所以10g镁和氧化镁的混合物与稀盐酸反应,右盘增加的质量一定大于10g−0.83g=9.17g,B不符合题意。根据化学方程式:$MgCO_{3}+2HCl\xlongequal{\;\;}MgCl_{2}+CO_{2}\uparrow+H_{2}O$可知,每84份质量的碳酸镁与73份质量的溶质HCl完全反应,生成44份质量的二氧化碳,现有7.3g HCl,能与8.4g碳酸镁反应生成4.4g二氧化碳气体,显然碳酸镁剩余1.6g,则右盘增加的质量为10g−4.4g=5.6g,C符合题意。碳酸钠与盐酸反应,碳酸钠和溶质HCl的质量比为106:73,碳酸锌与盐酸反应,碳酸锌与溶质HCl的质量比为125:73。显然,7.3gHCl要完全反应,需要消耗10.6g碳酸钠或12.5g碳酸锌,所以10g碳酸钠和碳酸锌的混合物与7.3g HCl反应,HCl有剩余,则产生的二氧化碳质量必小于4.4g,所以右盘增加的质量必大于5.6g,D不符合题意。
$CaCO_{3}+2HCl\xlongequal{\;\;}CaCl_{2}+H_{2}O+CO_{2}\uparrow$
100 44
10g x
$\frac{100}{44}=\frac{10g}{x}$ $x = 4.4g$
左盘增加的质量是10g−4.4g=5.6g,右盘增加的质量也应为5.6g,托盘天平才能保持平衡。因碳酸钙与盐酸恰好完全反应,所以可计算出消耗的溶质HCl的质量为7.3g。5.6g铁和锌的混合物与稀盐酸反应产生氢气,从而使右盘增加的质量小于5.6g,A不符合题意。假设10g物质全部是镁,设生成氢气的质量是a。
$Mg + 2HCl\xlongequal{\;\;}MgCl_{2}+H_{2}\uparrow$
24 2
10g a
$\frac{24}{2}=\frac{10g}{a}$ $a\approx0.83g$
氧化镁与盐酸反应生成氯化镁和水,所以10g镁和氧化镁的混合物与稀盐酸反应,右盘增加的质量一定大于10g−0.83g=9.17g,B不符合题意。根据化学方程式:$MgCO_{3}+2HCl\xlongequal{\;\;}MgCl_{2}+CO_{2}\uparrow+H_{2}O$可知,每84份质量的碳酸镁与73份质量的溶质HCl完全反应,生成44份质量的二氧化碳,现有7.3g HCl,能与8.4g碳酸镁反应生成4.4g二氧化碳气体,显然碳酸镁剩余1.6g,则右盘增加的质量为10g−4.4g=5.6g,C符合题意。碳酸钠与盐酸反应,碳酸钠和溶质HCl的质量比为106:73,碳酸锌与盐酸反应,碳酸锌与溶质HCl的质量比为125:73。显然,7.3gHCl要完全反应,需要消耗10.6g碳酸钠或12.5g碳酸锌,所以10g碳酸钠和碳酸锌的混合物与7.3g HCl反应,HCl有剩余,则产生的二氧化碳质量必小于4.4g,所以右盘增加的质量必大于5.6g,D不符合题意。
10. 从反应原理和产物纯度两个角度考虑,下列制取Fe₂(SO₄)₃溶液的方案中最佳的是 ( )
A. 过量的Fe粉与稀硫酸反应,过滤
B. 过量的Fe₂O₃与稀硫酸反应,过滤
C. 过量的稀硫酸与Fe₂O₃反应
D. 过量的Fe粉与CuSO₄溶液反应,过滤
A. 过量的Fe粉与稀硫酸反应,过滤
B. 过量的Fe₂O₃与稀硫酸反应,过滤
C. 过量的稀硫酸与Fe₂O₃反应
D. 过量的Fe粉与CuSO₄溶液反应,过滤
答案:
B
11. 在M+H₂SO₄→Fe₂(SO₄)₃+N(M、N分别代表一种物质,未配平)反应中,M可能是下列物质中的 ( )
①Fe ②Fe₂O₃ ③Fe(OH)₃ ④FeCl₂
A. ①②
B. ②③
C. ①②③
D. 全部
①Fe ②Fe₂O₃ ③Fe(OH)₃ ④FeCl₂
A. ①②
B. ②③
C. ①②③
D. 全部
答案:
B
12. 在利用黄铜(一种合金)制作机器零件的过程中会产生黄铜屑,经测定黄铜屑主要含锌、铜、氧化锌和氧化铜。下列分析错误的是 ( )
A. 将黄铜屑加入足量稀盐酸中,会有气泡产生
B. 将黄铜屑加入足量稀盐酸中,过滤后一定得到无色溶液
C. 根据黄铜屑的成分,可确定黄铜中含有锌和铜两种金属
D. 根据黄铜屑与足量稀盐酸反应的现象,可比较锌和铜的金属活动性强弱
A. 将黄铜屑加入足量稀盐酸中,会有气泡产生
B. 将黄铜屑加入足量稀盐酸中,过滤后一定得到无色溶液
C. 根据黄铜屑的成分,可确定黄铜中含有锌和铜两种金属
D. 根据黄铜屑与足量稀盐酸反应的现象,可比较锌和铜的金属活动性强弱
答案:
B
13. 小亮在实验室用足量的锌粒与稀硫酸按如图装置制取一定量的氢气时,发现液面刚好不与锌粒接触而又无酸液可加,若从长颈漏斗中加入适量的某种试剂,不影响生成氢气的质量,你认为下列最合适的是_______(填字母)。
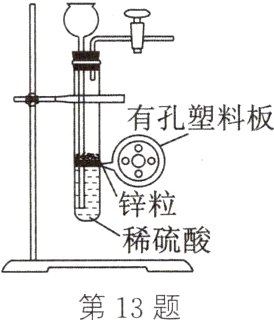
A. 氢氧化钠溶液
B. 碳酸钠溶液
C. 硫酸钠溶液
D. 澄清石灰水

A. 氢氧化钠溶液
B. 碳酸钠溶液
C. 硫酸钠溶液
D. 澄清石灰水
答案:
C 解析:根据题意,从长颈漏斗中加入适量的某种试剂,不影响生成氢气的质量,则加入的试剂应该具备以下条件:不能和容器中的物质(锌粒和稀硫酸)反应生成其他气体,能够让稀硫酸和锌混合生成氢气。C选项中硫酸钠和稀硫酸不反应,且符合情境所需条件,故C选项正确。
查看更多完整答案,请扫码查看


