第51页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
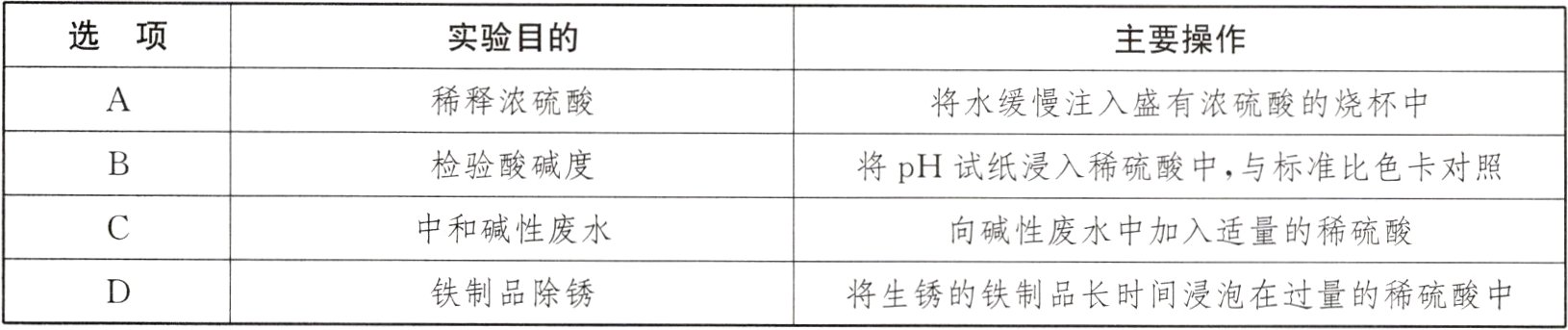
23. (2024·徐州)下列与硫酸相关的实验操作规范且能达到实验目的的是 ( )
|选项|实验目的|主要操作|
|----|----|----|
|A|稀释浓硫酸|将水缓慢注入盛有浓硫酸的烧杯中|
|B|检验酸碱度|将pH试纸浸入稀硫酸中,与标准比色卡对照|
|C|中和碱性废水|向碱性废水中加入适量的稀硫酸|
|D|铁制品除锈|将生锈的铁制品长时间浸泡在过量的稀硫酸中|
|选项|实验目的|主要操作|
|----|----|----|
|A|稀释浓硫酸|将水缓慢注入盛有浓硫酸的烧杯中|
|B|检验酸碱度|将pH试纸浸入稀硫酸中,与标准比色卡对照|
|C|中和碱性废水|向碱性废水中加入适量的稀硫酸|
|D|铁制品除锈|将生锈的铁制品长时间浸泡在过量的稀硫酸中|

答案:
C
24. (2024·徐州)人类开发利用金属的时间和金属的活动性有关。为探究金属的活动性强弱,用如图装置进行实验。下列说法不正确的是 ( )
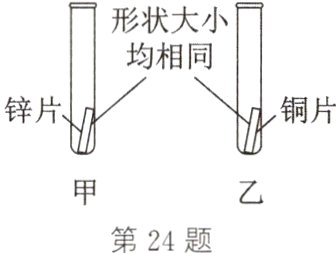
A. 实验前需要打磨金属片,除去表面的氧化膜
B. 若向甲、乙试管中加入稀盐酸,只有锌片表面能产生气泡
C. 若向乙试管中加入ZnSO₄溶液,能得出锌的金属活动性比铜强
D. 若向甲、乙试管中加入AgNO₃溶液,能得出三种金属的活动性:Zn>Cu>Ag

A. 实验前需要打磨金属片,除去表面的氧化膜
B. 若向甲、乙试管中加入稀盐酸,只有锌片表面能产生气泡
C. 若向乙试管中加入ZnSO₄溶液,能得出锌的金属活动性比铜强
D. 若向甲、乙试管中加入AgNO₃溶液,能得出三种金属的活动性:Zn>Cu>Ag
答案:
D
25. (2024·徐州)铝的应用涉及生产、生活的各个方面。工业上用铝土矿(主要成分为Al₂O₃,含砂石等杂质)制备铝的主要流程如图所示:

(1) 过程①②都包含固液分离的操作,该操作名称是__________。
(2) 为加快铝土矿与NaOH溶液反应的速率,可采取的措施是__________________。
(3) 生成Al(OH)₃的反应中,反应物除了有NaAlO₂、CO₂,还有一种氧化物为__________。
(4) 写出电解氧化铝获得铝的化学方程式:______________________________。

(1) 过程①②都包含固液分离的操作,该操作名称是__________。
(2) 为加快铝土矿与NaOH溶液反应的速率,可采取的措施是__________________。
(3) 生成Al(OH)₃的反应中,反应物除了有NaAlO₂、CO₂,还有一种氧化物为__________。
(4) 写出电解氧化铝获得铝的化学方程式:______________________________。
答案:
(1)过滤 (2)将铝土矿粉碾碎(合理答案均可) (3)水 (4)2Al₂O₃ $\stackrel{通电}{=\!=\!=}$ 4Al + 3O₂↑
26. (2023·徐州)物质的合理使用有利于社会的可持续发展,氨气在生产和生活中应用广泛。
(1) 氨气可作燃料,燃烧时发生的反应为$4NH₃+3O₂\xlongequal{点燃}2X+6H₂O,$X的化学式为__________。
(2) 氨气可用于合成氮肥。在氯化铵(NH₄Cl)、硫酸铵[(NH₄)₂SO₄]这两种铵态氮肥中,氮元素的质量分数较高的是__________。
(3) 氨气可用于处理酸性废水。工业上用氨气处理含有HCl的质量分数为0.365%的酸性废水2 000 kg,反应原理为NH₃+HCl=NH₄Cl。理论上需要氨气多少千克?(写出计算过程)
(1) 氨气可作燃料,燃烧时发生的反应为$4NH₃+3O₂\xlongequal{点燃}2X+6H₂O,$X的化学式为__________。
(2) 氨气可用于合成氮肥。在氯化铵(NH₄Cl)、硫酸铵[(NH₄)₂SO₄]这两种铵态氮肥中,氮元素的质量分数较高的是__________。
(3) 氨气可用于处理酸性废水。工业上用氨气处理含有HCl的质量分数为0.365%的酸性废水2 000 kg,反应原理为NH₃+HCl=NH₄Cl。理论上需要氨气多少千克?(写出计算过程)
答案:
(1)N₂ (2)氯化铵(或NH₄Cl) (3)解:设理论上需要氨气的质量为x。
NH₃ + HCl = NH₄Cl
17 36.5
x 2000 kg×0.365%
$\frac{17}{36.5}=\frac{x}{2000 kg×0.365\%}$ x = 3.4 kg
答:理论上需要氨气3.4 kg。
NH₃ + HCl = NH₄Cl
17 36.5
x 2000 kg×0.365%
$\frac{17}{36.5}=\frac{x}{2000 kg×0.365\%}$ x = 3.4 kg
答:理论上需要氨气3.4 kg。
查看更多完整答案,请扫码查看


