第8页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
8. (2024·十堰模拟)化学兴趣小组完成“金属的某些化学性质”的探究实验。实验最终观察到两支试管中均有固体残留(两支试管中残留固体的总质量为m),然后将两支试管中的物质全部倒入洁净的烧杯中,最终得到无色溶液a和固体b。下列说法错误的是( )
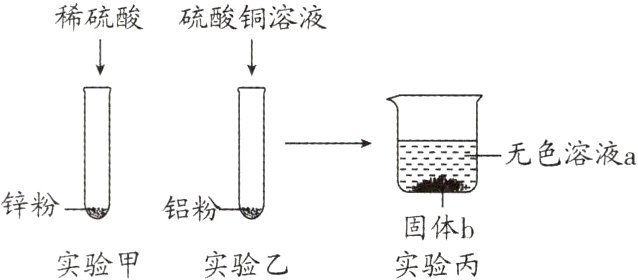
A. 实验乙溶液最终可能呈蓝色
B. 溶液a中可能含有两种金属离子
C. 固体b可能是一种纯净物
D. 固体b的质量一定小于m

A. 实验乙溶液最终可能呈蓝色
B. 溶液a中可能含有两种金属离子
C. 固体b可能是一种纯净物
D. 固体b的质量一定小于m
答案:
8. D 解析:实验甲:锌与稀硫酸反应生成硫酸锌和氢气,实验有固体残留,说明锌有剩余,硫酸完全反应;实验乙:铝与硫酸铜反应生成硫酸铝和铜,将两支试管中的物质全部倒入洁净的烧杯中,最终得到无色溶液a,说明硫酸铜完全反应。实验乙溶液最终可能有硫酸铜剩余,溶液呈蓝色,与甲混合后,锌与硫酸铜继续反应生成铜和硫酸锌,最终溶液呈无色,A正确;金属活动性:铝>锌>铜,无色溶液a中一定含有硫酸铝,若乙中铝有剩余,铝会与甲中的硫酸锌反应生成锌和硫酸铝,硫酸锌可能有剩余,也可能反应完,所以无色溶液a中可能含有硫酸锌,B正确;固体b中一定含有铜,甲中剩余的锌可能会与乙中剩余的硫酸铜反应,所以固体b可能只有铜,是一种纯净物,C正确;若乙中剩余铝,根据$2Al + 3ZnSO_{4}=Al_{2}(SO_{4})_{3}+3Zn$,反应后固体的质量增加,D错误。
9. 新题型(2024·六安月考)模型能够直观反映化学变化的结果。将一定质量的镁条放入某溶液中(如图),其溶液中所含硫酸锌和硫酸亚铁的质量相同,充分反应后烧杯内固体的组成和质量大小关系不可能的是( )


答案:
9. C 解析:镁、锌、铁的金属活动性:镁>锌>铁,将镁条加入硫酸锌和硫酸亚铁的溶液中,镁先与硫酸亚铁反应生成硫酸镁和铁,反应方程式为$Mg + FeSO_{4}=MgSO_{4}+Fe$,即每24份质量的镁能置换出56份质量的铁,硫酸亚铁完全反应之后,若镁还有剩余,镁再与硫酸锌反应生成硫酸镁和锌,反应方程式为$Mg + ZnSO_{4}=MgSO_{4}+Zn$,即每24份质量的镁能置换出65份质量的锌,溶液中所含硫酸锌和硫酸亚铁质量相等,设质量为$m$ g,则$m$ g硫酸锌中锌元素的质量为$m\times\frac{65}{161}\approx0.4m$ g,$m$ g硫酸亚铁中铁元素的质量为$m\times\frac{56}{152}\approx0.37m$ g。由图A知,镁无剩余,可能硫酸亚铁完全反应,且硫酸锌反应了一部分,则生成的铁和锌的质量可能相等,A正确;由图B知,镁无剩余,可能硫酸亚铁完全反应完,且硫酸锌反应了一部分,则生成的铁的质量可能大于生成的锌的质量,B正确;由图C知,镁有剩余,硫酸亚铁和硫酸锌均反应完全,由上述分析知等质量的硫酸锌和硫酸亚铁完全反应,生成铁的质量一定小于生成锌的质量,而图示中生成铁和锌的质量相等是不合理的,C错误;由图D知,镁有剩余,硫酸亚铁和硫酸锌均反应完全,由上述分析知等质量的硫酸锌和硫酸亚铁完全反应,生成铁的质量一定小于生成锌的质量,D正确。
10. 向盛有硝酸银和硝酸亚铁的混合溶液中缓缓加入锌粉,经搅拌使锌粉与溶液中所含的物质恰好完全反应。现根据可能出现的情况,以加入锌粉的质量为横坐标,以烧杯中生成的固体质量为纵坐标(横纵坐标分度值相同),小科同学分别做出了三幅关系图。其中A点表示锌粉与溶液中所含的物质恰好完全反应时的质量。下列说法正确的是( )

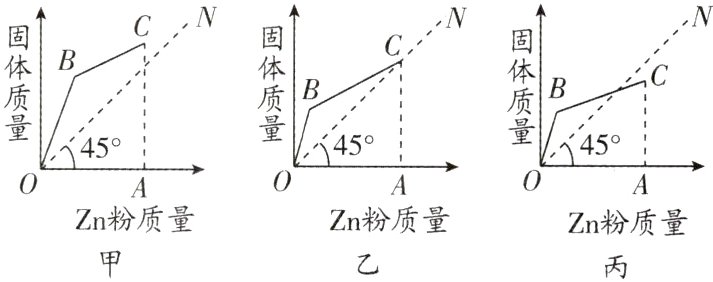
A. 线段BC表示锌与硝酸银的反应
B. 丙图表示反应结束时,参加反应的锌的质量大于生成的银与铁的总质量
C. 反应结束时,三种情况的溶液中所含的物质(除水外)种类不同
D. OB与x轴夹角>45°,BC与x轴夹角<45°的主要原因是三种金属的活动性不同


A. 线段BC表示锌与硝酸银的反应
B. 丙图表示反应结束时,参加反应的锌的质量大于生成的银与铁的总质量
C. 反应结束时,三种情况的溶液中所含的物质(除水外)种类不同
D. OB与x轴夹角>45°,BC与x轴夹角<45°的主要原因是三种金属的活动性不同
答案:
10. B 解析:锌的金属活动性比银、铁强,向盛有硝酸银和硝酸亚铁的混合溶液中缓缓加入锌粉,经搅拌使锌粉与溶液中所含的物质恰好完全反应,锌粉先与硝酸银反应生成硝酸锌和银,硝酸银反应完,锌粉才能与硝酸亚铁反应生成硝酸锌和铁,根据反应$Zn + 2AgNO_{3}=Zn(NO_{3})_{2}+2Ag$,由反应时的质量比可知,每65份质量的锌可置换出216份质量的银,固体的质量会增加;根据反应$Zn + Fe(NO_{3})_{2}=Zn(NO_{3})_{2}+Fe$,每65份质量的锌可置换出56份质量的铁,固体的质量会减少。当增加的质量大于减少的质量时,甲正确;当增加的质量等于减少的质量时,乙正确;当增加的质量小于减少的质量时,丙正确;图像甲、乙、丙均有可能正确。线段BC表示锌与硝酸亚铁的反应,A错误;丙图表示反应结束时,参加反应的锌的质量大于生成的银与铁的总质量,B正确;反应结束时,三种情况的溶液中所含的物质(除水外)种类是相同的,均是硝酸锌,C错误;线段OB与x轴夹角>45°>线段BC与x轴夹角的主要原因是三种金属的质量不同,D错误。
11. 人类社会发展离不开金属材料,铝合金是工业中应用最广泛的金属材料之一。
(1)硬铝中主要含铝、镁、铜。将适量硬铝(已用砂纸打磨处理)放入足量稀硫酸(不考虑杂质与硫酸反应)中,反应的化学方程式有______。
(2)将足量硬铝粉末放入硝酸银溶液中,充分反应后,溶液出现蓝色,写出此时溶液中所含的阳离子:______。
(3)利用下图的实验方案从含有氯化亚铁、氯化铜的废液中回收金属铜和氯化亚铁晶体。

①操作Ⅱ中加入过量的试剂B的目的是______。
②操作Ⅲ除去的物质是______(填化学式)。
(4)Mg的活动性大于Al,请设计实验方案验证:______(写出具体的操作和现象)。
(1)硬铝中主要含铝、镁、铜。将适量硬铝(已用砂纸打磨处理)放入足量稀硫酸(不考虑杂质与硫酸反应)中,反应的化学方程式有______。
(2)将足量硬铝粉末放入硝酸银溶液中,充分反应后,溶液出现蓝色,写出此时溶液中所含的阳离子:______。
(3)利用下图的实验方案从含有氯化亚铁、氯化铜的废液中回收金属铜和氯化亚铁晶体。

①操作Ⅱ中加入过量的试剂B的目的是______。
②操作Ⅲ除去的物质是______(填化学式)。
(4)Mg的活动性大于Al,请设计实验方案验证:______(写出具体的操作和现象)。
答案:
11.
(1)$Mg + H_{2}SO_{4}=MgSO_{4}+H_{2}\uparrow$、$2Al + 3H_{2}SO_{4}=Al_{2}(SO_{4})_{3}+3H_{2}\uparrow$
(2)$Mg^{2+}$、$Al^{3+}$、$Cu^{2+}$
(3)①除去过量的铁 ②$HCl$、$H_{2}O$
(4)在相同的试管中放入打磨后相同形状、大小的镁条、铝条,同时加入相同浓度等质量的稀盐酸,观察气体产生的速率,镁比铝产生气体的速率更快(合理即可)
解析:
(1)活动性:镁>铝>氢>铜,则镁和稀硫酸反应产生硫酸镁和氢气,铝和稀硫酸反应产生硫酸铝和氢气,铜不与稀硫酸反应。
(2)活动性:镁>铝>氢>铜>银,则镁先与硝酸银反应产生硝酸镁和银,硝酸银剩余,铝和硝酸银反应产生硝酸铝和银,硝酸银还有剩余,则铜和硝酸银反应产生硝酸铜和银;溶液为蓝色,说明溶液中含有硝酸铜,则镁、铝和铜都参加了反应,由于加入的硬铝粉末足量,硝酸银没有剩余,则此时溶液中所含的阳离子有$Mg^{2+}$、$Al^{3+}$、$Cu^{2+}$。
(3)①废液中主要含有氯化亚铁和氯化铜,实验目的是回收铜和氯化亚铁晶体,故加入过量的试剂A是铁,铁能与氯化铜反应生成氯化亚铁和铜,故固体C中含有反应生成的铜和过量的铁,除去铁可加入过量的稀盐酸(B),因为稀盐酸能与铁反应生成氯化亚铁和氢气;操作Ⅱ中加入过量的试剂B的目的是除去过量的铁;②根据上述分析,溶液F中含有氯化亚铁和盐酸,蒸发时,氯化氢会挥发除去,故除去的物质是$HCl$、$H_{2}O$。
(4)验证金属的活动性要注意控制变量,如金属的形状、大小及酸的浓度、用量等,可以利用金属和酸的反应,也可以用金属和金属化合物溶液的反应。
(1)$Mg + H_{2}SO_{4}=MgSO_{4}+H_{2}\uparrow$、$2Al + 3H_{2}SO_{4}=Al_{2}(SO_{4})_{3}+3H_{2}\uparrow$
(2)$Mg^{2+}$、$Al^{3+}$、$Cu^{2+}$
(3)①除去过量的铁 ②$HCl$、$H_{2}O$
(4)在相同的试管中放入打磨后相同形状、大小的镁条、铝条,同时加入相同浓度等质量的稀盐酸,观察气体产生的速率,镁比铝产生气体的速率更快(合理即可)
解析:
(1)活动性:镁>铝>氢>铜,则镁和稀硫酸反应产生硫酸镁和氢气,铝和稀硫酸反应产生硫酸铝和氢气,铜不与稀硫酸反应。
(2)活动性:镁>铝>氢>铜>银,则镁先与硝酸银反应产生硝酸镁和银,硝酸银剩余,铝和硝酸银反应产生硝酸铝和银,硝酸银还有剩余,则铜和硝酸银反应产生硝酸铜和银;溶液为蓝色,说明溶液中含有硝酸铜,则镁、铝和铜都参加了反应,由于加入的硬铝粉末足量,硝酸银没有剩余,则此时溶液中所含的阳离子有$Mg^{2+}$、$Al^{3+}$、$Cu^{2+}$。
(3)①废液中主要含有氯化亚铁和氯化铜,实验目的是回收铜和氯化亚铁晶体,故加入过量的试剂A是铁,铁能与氯化铜反应生成氯化亚铁和铜,故固体C中含有反应生成的铜和过量的铁,除去铁可加入过量的稀盐酸(B),因为稀盐酸能与铁反应生成氯化亚铁和氢气;操作Ⅱ中加入过量的试剂B的目的是除去过量的铁;②根据上述分析,溶液F中含有氯化亚铁和盐酸,蒸发时,氯化氢会挥发除去,故除去的物质是$HCl$、$H_{2}O$。
(4)验证金属的活动性要注意控制变量,如金属的形状、大小及酸的浓度、用量等,可以利用金属和酸的反应,也可以用金属和金属化合物溶液的反应。
查看更多完整答案,请扫码查看


