第37页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
8.(2023·邵阳模拟)向质量分数为20%的氯化钠溶液中,加入3 g氯化钠和12 g水,使其完全溶解,所得溶液中溶质的质量分数是( )
A. 25%
B. 20.5%
C. 20%
D. 无法求解
A. 25%
B. 20.5%
C. 20%
D. 无法求解
答案:
C 解析:3 g氯化钠和12 g水所得溶液的质量分数 = $\frac{3 g}{3 g + 12 g}$×100% = 20%,与原溶液浓度相同,故所得溶液中溶质的质量分数为20%;故选C。
9. 如图所示为蒸发氯化钠溶液的过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,则下列溶液的溶质质量分数与蒸发过程描述正确的是( )


答案:
A 解析:在①→②过程中,氯化钠的溶解度不变,溶液由不饱和变为饱和,溶质的质量分数变大,②与③都是同温度下的饱和溶液,所以溶质的质量分数应该相等,③→④升温蒸发水分,此时溶解度变大,溶质的质量分数:④>③,A正确。
10. 已知M物质的溶解度随温度升高而增大。将80 g M物质加入50 g水中,充分溶解,所得溶液质量如图所示。A点时,该溶液的溶质质量分数为_______;向B点对应的溶液中加入70 g水,所得溶液的溶质质量分数是_______;C点所对应的溶液是_______(填“饱和”或“不饱和”)溶液。
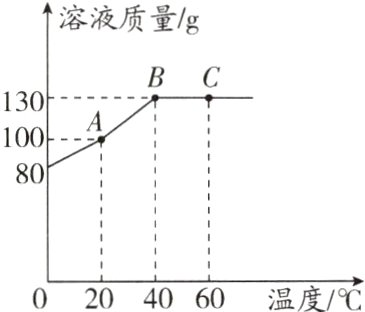

答案:
50% 40% 不饱和
解析:A点时,该溶液的溶质质量分数为$\frac{50 g}{100 g}$×100% = 50%;向B点对应的溶液中加入70 g水,所得溶液的溶质质量分数为$\frac{80 g}{130 g + 70 g}$×100% = 40%;已知M物质的溶解度随温度升高而增大,在B点时M已经完全溶解,则C点所对应的溶液肯定是不饱和溶液。
解析:A点时,该溶液的溶质质量分数为$\frac{50 g}{100 g}$×100% = 50%;向B点对应的溶液中加入70 g水,所得溶液的溶质质量分数为$\frac{80 g}{130 g + 70 g}$×100% = 40%;已知M物质的溶解度随温度升高而增大,在B点时M已经完全溶解,则C点所对应的溶液肯定是不饱和溶液。
11. 思想方法 守恒法(2023·扬州月考)按照我国《食品添加剂使用标准(GB2760 - 2014)》,合理使用SO₂不会对人体健康造成危害。如葡萄酒酿制中适量添加SO₂,可防止葡萄酒在陈酿和贮藏过程中被氧化。《标准》中部分食品SO₂的最大残留量如表:

兴趣小组同学用高锰酸钾溶液对某种白葡萄酒中SO₂残留量进行测定(SO₂能使高锰酸钾溶液褪色),反应的化学原理为2KMnO₄ + 5SO₂ + 2H₂O = 2MnSO₄ + 2H₂SO₄ + K₂SO₄。
(1)实验步骤如下:
步骤1:配制高锰酸钾溶液:将20 g 7.9%高锰酸钾溶液稀释成0.395%的高锰酸钾溶液,需要加水_______mL。
步骤2:取10 g 0.395%的高锰酸钾溶液于烧杯中,缓缓加入该品牌白葡萄酒,边加边搅拌,当加入100 mL白葡萄酒时,高锰酸钾溶液恰好褪色。
(2)通过计算说明该品牌葡萄酒中SO₂的残留量是否符合标准。

兴趣小组同学用高锰酸钾溶液对某种白葡萄酒中SO₂残留量进行测定(SO₂能使高锰酸钾溶液褪色),反应的化学原理为2KMnO₄ + 5SO₂ + 2H₂O = 2MnSO₄ + 2H₂SO₄ + K₂SO₄。
(1)实验步骤如下:
步骤1:配制高锰酸钾溶液:将20 g 7.9%高锰酸钾溶液稀释成0.395%的高锰酸钾溶液,需要加水_______mL。
步骤2:取10 g 0.395%的高锰酸钾溶液于烧杯中,缓缓加入该品牌白葡萄酒,边加边搅拌,当加入100 mL白葡萄酒时,高锰酸钾溶液恰好褪色。
(2)通过计算说明该品牌葡萄酒中SO₂的残留量是否符合标准。
答案:
(1)380
(2)解:设100 mL白葡萄酒中二氧化硫的质量为x。
2KMnO₄ + 5SO₂ + 2H₂O = 2MnSO₄ + 2H₂SO₄ + K₂SO₄
316 320
10 g×0.395% x
$\frac{316}{320}$ = $\frac{10 g×0.395%}{x}$ x = 0.04 g
即1 L白葡萄酒中含有0.4 g二氧化硫,0.4 g > 0.25 g,故该品牌葡萄酒中SO₂的残留量不符合标准。
解析:
(1)设需要加水的质量为m,稀释前后溶质质量不变,20 g×7.9% = 0.395%×(20 g + m),m = 380 g,需要加水的质量为380 g,加水的体积 = $\frac{380 g}{1 g/mL}$ = 380 mL。
(1)380
(2)解:设100 mL白葡萄酒中二氧化硫的质量为x。
2KMnO₄ + 5SO₂ + 2H₂O = 2MnSO₄ + 2H₂SO₄ + K₂SO₄
316 320
10 g×0.395% x
$\frac{316}{320}$ = $\frac{10 g×0.395%}{x}$ x = 0.04 g
即1 L白葡萄酒中含有0.4 g二氧化硫,0.4 g > 0.25 g,故该品牌葡萄酒中SO₂的残留量不符合标准。
解析:
(1)设需要加水的质量为m,稀释前后溶质质量不变,20 g×7.9% = 0.395%×(20 g + m),m = 380 g,需要加水的质量为380 g,加水的体积 = $\frac{380 g}{1 g/mL}$ = 380 mL。
12.(2024·重庆中考)Na₂SO₃曾作为照相中的显影剂,可由2NaHSO₃ + Na₂CO₃ $\xlongequal{\triangle}$ 2Na₂SO₃ + CO₂↑ + H₂O制得。取100 g NaHSO₃溶液,加入5.3 g Na₂CO₃固体,两者恰好完全反应(不考虑水的挥发)。试计算:(可能用到的部分相对分子质量:NaHSO₃—104 Na₂SO₃—126)
(1)Na₂SO₃中钠元素与氧元素的质量比为_______。
(2)NaHSO₃溶液中溶质的质量分数(结果精确到0.1%,下同)。
(3)所得溶液中溶质的质量分数。
(1)Na₂SO₃中钠元素与氧元素的质量比为_______。
(2)NaHSO₃溶液中溶质的质量分数(结果精确到0.1%,下同)。
(3)所得溶液中溶质的质量分数。
答案:
(1)23 : 24
(2)解:设参加反应的NaHSO₃的质量为x,生成Na₂SO₃的质量为y,生成CO₂的质量为z。
2NaHSO₃ + Na₂CO₃ $\stackrel{\triangle}{=}$ 2Na₂SO₃ + CO₂↑ + H₂O
208 106 252 44
x 5.3 g y z
$\frac{208}{106}$ = $\frac{x}{5.3 g}$ x = 10.4 g
$\frac{106}{252}$ = $\frac{5.3 g}{y}$ y = 12.6 g
$\frac{106}{44}$ = $\frac{5.3 g}{z}$ z = 2.2 g
NaHSO₃溶液中溶质的质量分数为$\frac{10.4 g}{100 g}$×100% = 10.4%
答:NaHSO₃溶液中溶质的质量分数为10.4%。
(3)反应后溶液的质量为100 g + 5.3 g - 2.2 g = 103.1 g,所得溶液中溶质的质量分数为$\frac{12.6 g}{103.1 g}$×100%≈12.2%
答:所得溶液中溶质的质量分数为12.2%。
(1)23 : 24
(2)解:设参加反应的NaHSO₃的质量为x,生成Na₂SO₃的质量为y,生成CO₂的质量为z。
2NaHSO₃ + Na₂CO₃ $\stackrel{\triangle}{=}$ 2Na₂SO₃ + CO₂↑ + H₂O
208 106 252 44
x 5.3 g y z
$\frac{208}{106}$ = $\frac{x}{5.3 g}$ x = 10.4 g
$\frac{106}{252}$ = $\frac{5.3 g}{y}$ y = 12.6 g
$\frac{106}{44}$ = $\frac{5.3 g}{z}$ z = 2.2 g
NaHSO₃溶液中溶质的质量分数为$\frac{10.4 g}{100 g}$×100% = 10.4%
答:NaHSO₃溶液中溶质的质量分数为10.4%。
(3)反应后溶液的质量为100 g + 5.3 g - 2.2 g = 103.1 g,所得溶液中溶质的质量分数为$\frac{12.6 g}{103.1 g}$×100%≈12.2%
答:所得溶液中溶质的质量分数为12.2%。
查看更多完整答案,请扫码查看


