第11页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
6.(2022·无锡中考)走近千年文物,人们发现青铜器在含有Cl⁻的环境中易生成CuCl,随着环境条件的变化而发生锈蚀,锈层物质成分示意图如图所示。下列叙述错误的是( )

A. 铜绿中含有Cu、H、O、C四种元素
B. CuCl与O₂、H₂O发生化合反应生成Cu₂(OH)₃Cl
C. 青铜器在锈蚀的过程中铜元素的化合价升高
D. 在干燥、无氧的环境中有利于青铜器的保护

A. 铜绿中含有Cu、H、O、C四种元素
B. CuCl与O₂、H₂O发生化合反应生成Cu₂(OH)₃Cl
C. 青铜器在锈蚀的过程中铜元素的化合价升高
D. 在干燥、无氧的环境中有利于青铜器的保护
答案:
B 解析:$CuCl$中$Cu$、$Cl$原子个数比为$1:1$,$Cu_{2}(OH)_{3}Cl$中$Cu$、$Cl$原子个数比为$2:1$,因此生成物中一定还有含$Cl$元素的化合物,即该反应的生成物不止一种,不是化合反应,故B错误。
7. 新趋势 创新实验题 如图为CO还原Fe₂O₃的微型实验装置(夹持仪器已略去),甲酸在热的浓硫酸作用下分解生成CO,利用CO还原Fe₂O₃(已知:$HCOOH\xlongequal[\Delta ]{浓H_{2}SO_{4}}H₂O + CO↑)。$下列有关该实验的说法错误的是( )
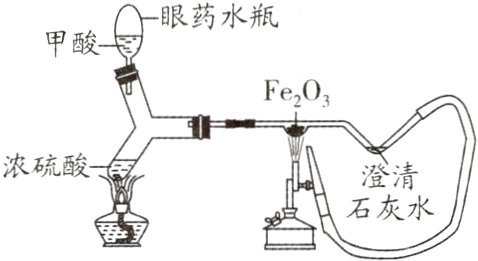
A. 此装置内空间较小,空气易排尽,实验危险系数小
B. 此实验装置的主要优点是尾气处理有效节能
C. 该实验中CO既表现出还原性,又表现出可燃性
D. 该实验中观察到的现象是红色固体变成了银白色,澄清石灰水变浑浊

A. 此装置内空间较小,空气易排尽,实验危险系数小
B. 此实验装置的主要优点是尾气处理有效节能
C. 该实验中CO既表现出还原性,又表现出可燃性
D. 该实验中观察到的现象是红色固体变成了银白色,澄清石灰水变浑浊
答案:
D
8.(2024·厦门模拟)某研究小组进行钢铁锈蚀速率影响因素的探究,按如图1所示连接实验装置,同时插入氧气传感器,采集三个实验装置中氧气的体积分数数据,得到如图2所示的曲线。实验中食盐水和稀醋酸浓度相同,下列有关说法错误的是( )
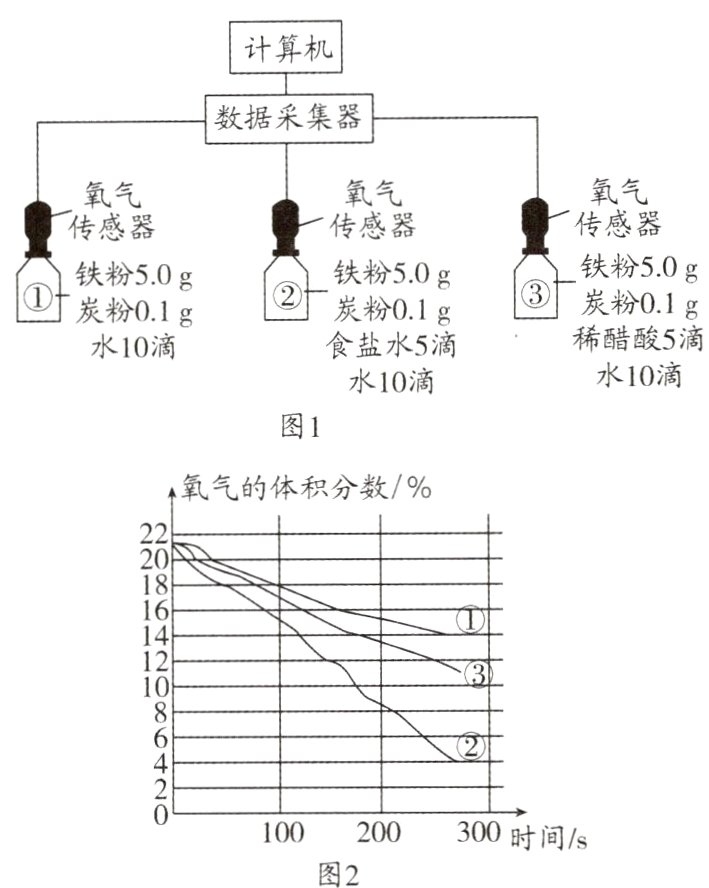
A. 该实验无法得出铁生锈的条件
B. 其他条件相同时,稀醋酸比食盐水更能加快铁的锈蚀速率
C. 实验过程中可以看到实验②的底部最先有红棕色固体生成
D. 与课本中探究铁生锈的实验对比,该实验的优点是耗时短、更直观

A. 该实验无法得出铁生锈的条件
B. 其他条件相同时,稀醋酸比食盐水更能加快铁的锈蚀速率
C. 实验过程中可以看到实验②的底部最先有红棕色固体生成
D. 与课本中探究铁生锈的实验对比,该实验的优点是耗时短、更直观
答案:
B
9.(2024·扬州一模)春秋初期,在1 000 ℃左右的温度下,使木炭和赤铁矿发生一系列的反应可生成含较多杂质的海绵铁。当代工业中,海绵铁可用于生产羰基铁粉[制备羰基铁粉Fe(CO)₅的过程如图所示],运用于国防军工领域。下列说法正确的是( )

A. 海绵铁是单质
B. 炼制海绵铁的过程中,木炭只作为燃料使用
C. 工业上,用160 t的赤铁矿,可制得112 t的铁粉
D. 制备羰基铁粉过程中,循环利用的物质是CO

A. 海绵铁是单质
B. 炼制海绵铁的过程中,木炭只作为燃料使用
C. 工业上,用160 t的赤铁矿,可制得112 t的铁粉
D. 制备羰基铁粉过程中,循环利用的物质是CO
答案:
D 解析:海绵铁含有铁和较多杂质,是混合物,A错误;木炭不完全燃烧还可以生成一氧化碳,可用于炼铁,因此炼制海绵铁的过程中,木炭不只是作为燃料使用,还可以作为制造一氧化碳的原料,B错误;赤铁矿的主要成分是氧化铁,工业上,一氧化碳和氧化铁高温下反应生成铁和二氧化碳,化学方程式为$Fe_{2}O_{3}+3CO\stackrel{高温}{=\!=\!=}2Fe + 3CO_{2}$,氧化铁和铁的质量比为$160:112$,所以$160t$的氧化铁可以制得$112t$的铁粉,而$160t$的赤铁矿中还含有杂质,所以不能够制得$112t$的铁粉,C错误;由图示可知,一氧化碳既是反应物,又是生成物,可循环利用,D正确。
10. 新素材(2023·佛山三模)低碳冶金技术的发展为我国实现2060年“碳中和”目标提供了有力的保障,其中氢冶金技术成为最受关注的领域。目前,氢气主要来源于化石燃料制氢,竖炉氢冶炼铁工艺流程如图所示。

(1)“煤造气”过程发生的反应之一如下:$C + H₂O\xlongequal{高温}______ + H₂,$该反应中碳体现出______性。
(2)用氢气代替一氧化碳炼铁可有效降低二氧化碳的排放。计算用氢气冶炼1 000 t赤铁矿(纯度为80%)时,可减少排放二氧化碳的质量。(写出计算过程)
(3)某种热分析仪记录下48.0 g Fe₂O₃被H₂逐步还原成铁的有关数据,得到固体质量与反应温度的关系曲线如图所示,计算分析P点固体的化学式为________。
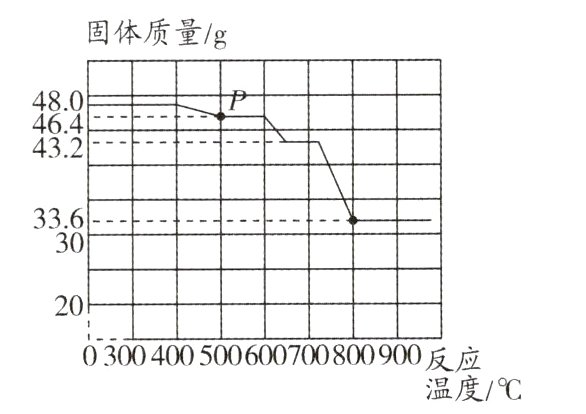

(1)“煤造气”过程发生的反应之一如下:$C + H₂O\xlongequal{高温}______ + H₂,$该反应中碳体现出______性。
(2)用氢气代替一氧化碳炼铁可有效降低二氧化碳的排放。计算用氢气冶炼1 000 t赤铁矿(纯度为80%)时,可减少排放二氧化碳的质量。(写出计算过程)
(3)某种热分析仪记录下48.0 g Fe₂O₃被H₂逐步还原成铁的有关数据,得到固体质量与反应温度的关系曲线如图所示,计算分析P点固体的化学式为________。

答案:
(1)$CO$ 还原
(2)解:设冶炼$1000t$赤铁矿(纯度为$80\%$)时,产生二氧化碳的质量为$x$,则
$Fe_{2}O_{3}+3CO\stackrel{高温}{=\!=\!=}2Fe + 3CO_{2}$
$160$ $132$
$1000t×80\%$ $x$
$\frac{160}{132}=\frac{1000t×80\%}{x}$
解得$x = 660t$
答:可减少排放二氧化碳的质量为$660t$。
(3)$Fe_{3}O_{4}$
解析:
(3)$48.0gFe_{2}O_{3}$中铁元素的质量为$48.0g×\frac{56×2}{56×2 + 16×3}×100\% = 33.6g$,而反应过程中,固体中铁元素质量不变,则$P$点固体中氧元素的质量为$46.4g - 33.6g = 12.8g$,则此时固体中铁、氧原子个数比为$\frac{33.6g}{56}:\frac{12.8g}{16}=3:4$,则$P$点固体的化学式为$Fe_{3}O_{4}$。
(1)$CO$ 还原
(2)解:设冶炼$1000t$赤铁矿(纯度为$80\%$)时,产生二氧化碳的质量为$x$,则
$Fe_{2}O_{3}+3CO\stackrel{高温}{=\!=\!=}2Fe + 3CO_{2}$
$160$ $132$
$1000t×80\%$ $x$
$\frac{160}{132}=\frac{1000t×80\%}{x}$
解得$x = 660t$
答:可减少排放二氧化碳的质量为$660t$。
(3)$Fe_{3}O_{4}$
解析:
(3)$48.0gFe_{2}O_{3}$中铁元素的质量为$48.0g×\frac{56×2}{56×2 + 16×3}×100\% = 33.6g$,而反应过程中,固体中铁元素质量不变,则$P$点固体中氧元素的质量为$46.4g - 33.6g = 12.8g$,则此时固体中铁、氧原子个数比为$\frac{33.6g}{56}:\frac{12.8g}{16}=3:4$,则$P$点固体的化学式为$Fe_{3}O_{4}$。
查看更多完整答案,请扫码查看


