第68页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
7.(2024·大庆中考)碳酸锂Li₂CO₃是制备新能源汽车电池的重要原料。下图是模拟提纯碳酸锂的工艺流程图。

已知:Ⅰ. 锂辉矿主要成分为Li₂CO₃,含泥沙等杂质。
Ⅱ. Li₂CO₃(化学性质与Na₂CO₃类似)为无色晶体,室温时微溶于水,在冷水中的溶解度比热水中大。
下列说法错误的是 ( )
A. X可以是稀硫酸,常用澄清石灰水检验气体Y
B. 将滤液2蒸发,当有较多固体出现时,停止加热
C. ②中适宜用冷饱和Na₂CO₃溶液
D. 此工艺可获得副产品Na₂SO₄

已知:Ⅰ. 锂辉矿主要成分为Li₂CO₃,含泥沙等杂质。
Ⅱ. Li₂CO₃(化学性质与Na₂CO₃类似)为无色晶体,室温时微溶于水,在冷水中的溶解度比热水中大。
下列说法错误的是 ( )
A. X可以是稀硫酸,常用澄清石灰水检验气体Y
B. 将滤液2蒸发,当有较多固体出现时,停止加热
C. ②中适宜用冷饱和Na₂CO₃溶液
D. 此工艺可获得副产品Na₂SO₄
答案:
C 解析:锂辉矿主要成分为Li₂CO₃,加入过量的X与碳酸锂反应生成滤液1,滤液1经处理得到较纯的硫酸锂溶液,根据质量守恒定律可知,X中含有硫元素,所以X可以为稀硫酸,硫酸与碳酸锂反应生成硫酸锂、二氧化碳和水,Y为二氧化碳,检验二氧化碳常用澄清石灰水,A正确;蒸发结晶时,当有较多固体出现时,停止加热,利用蒸发皿的余热将剩余的水分蒸干,B正确;Li₂CO₃为无色晶体,微溶于水,在冷水中的溶解度比热水中大,所以②中适宜用热的饱和Na₂CO₃溶液,此时碳酸锂易结晶析出,C错误;根据质量守恒定律可知,反应②硫酸锂与碳酸钠反应生成碳酸锂的同时生成硫酸钠,故此工艺可获得副产品Na₂SO₄,D正确。
8.(2023·咸宁中考)某实验小组用一定量大理石(杂质不与盐酸反应也不溶于水)和30 g溶质质量分数为7.3%的稀盐酸反应制取二氧化碳,充分反应后,将反应后的剩余物过滤(不考虑溶质损失),向滤液中逐滴滴加溶质质量分数为10.6%的碳酸钠溶液,测得滤液的pH与加入溶液质量的关系如图所示。已知氯化钙溶液呈中性,碳酸钠溶液呈碱性。下列有关分析不正确的是 ( )
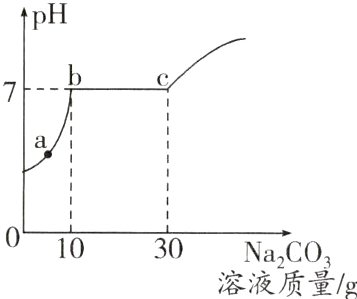
A. 大理石与稀盐酸反应产生CO₂的质量为0.88 g
B. c点对应的溶液中溶质的质量为2.34 g
C. a点对应的溶液中有三种溶质
D. bc段发生反应的化学方程式为Na₂CO₃ + CaCl₂$\xlongequal{\;\;}$CaCO₃↓ + 2NaCl

A. 大理石与稀盐酸反应产生CO₂的质量为0.88 g
B. c点对应的溶液中溶质的质量为2.34 g
C. a点对应的溶液中有三种溶质
D. bc段发生反应的化学方程式为Na₂CO₃ + CaCl₂$\xlongequal{\;\;}$CaCO₃↓ + 2NaCl
答案:
B 解析:大理石中的碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,由图可知,滤液pH<7,则说明酸过量,则滤液中含有氯化氢和氯化钙,向滤液中加入碳酸钠,碳酸钠先与盐酸反应生成氯化钠、水和二氧化碳,后与氯化钙反应生成碳酸钙沉淀和氯化钠,设与碳酸钠反应的盐酸的质量为x,则:
Na₂CO₃ + 2HCl = 2NaCl + H₂O + CO₂↑
106 73
10g×10.6% 7.3%·x
$\frac{106}{73}=\frac{10g×10.6\%}{7.3\%·x}$
解得x = 10g
则与碳酸钙反应的盐酸的质量为30g - 10g = 20g,设生成二氧化碳的质量为y,则:
CaCO₃ + 2HCl = CaCl₂ + H₂O + CO₂↑
73 44
20g×7.3% y
$\frac{73}{44}=\frac{20g×7.3\%}{y}$
解得y = 0.88g,A正确;结合前面分析可知,c点时溶液中的溶质为氯化钠,再结合氯元素守恒,设此时溶液中溶质的质量为z,则:
HCl ~ NaCl
36.5 58.5
30g×7.3% z
$\frac{36.5}{58.5}=\frac{30g×7.3\%}{z}$
解得z = 3.51g,B不正确;结合前面分析可知,a点时溶液中的盐酸还未完全反应,则溶液中的溶质为氯化钙、氯化钠和氯化氢,共有三种,C正确;结合前面分析可知,bc段发生的反应为氯化钙和碳酸钠的反应,反应的化学方程式为Na₂CO₃ + CaCl₂ = CaCO₃↓ + 2NaCl,D正确。
Na₂CO₃ + 2HCl = 2NaCl + H₂O + CO₂↑
106 73
10g×10.6% 7.3%·x
$\frac{106}{73}=\frac{10g×10.6\%}{7.3\%·x}$
解得x = 10g
则与碳酸钙反应的盐酸的质量为30g - 10g = 20g,设生成二氧化碳的质量为y,则:
CaCO₃ + 2HCl = CaCl₂ + H₂O + CO₂↑
73 44
20g×7.3% y
$\frac{73}{44}=\frac{20g×7.3\%}{y}$
解得y = 0.88g,A正确;结合前面分析可知,c点时溶液中的溶质为氯化钠,再结合氯元素守恒,设此时溶液中溶质的质量为z,则:
HCl ~ NaCl
36.5 58.5
30g×7.3% z
$\frac{36.5}{58.5}=\frac{30g×7.3\%}{z}$
解得z = 3.51g,B不正确;结合前面分析可知,a点时溶液中的盐酸还未完全反应,则溶液中的溶质为氯化钙、氯化钠和氯化氢,共有三种,C正确;结合前面分析可知,bc段发生的反应为氯化钙和碳酸钠的反应,反应的化学方程式为Na₂CO₃ + CaCl₂ = CaCO₃↓ + 2NaCl,D正确。
9. 思想方法 对比法 (2024·湖北中考)NaHCO₃是治疗胃酸过多症的一种抗酸药。某学习小组在室温下,对Na₂CO₃是否适合作为抗酸药进行了如下探究。
【查阅资料】
(1)①NaHCO₃俗称小苏打,Na₂CO₃俗称__________。
②人体胃液(含有盐酸)通常约100 mL,pH约1.5,体温约37 ℃。
③抗酸药的标准之一:药物发生疗效时,胃液的pH保持在3~5之间最宜,pH过高会导致胃痛等不适症状。
【提出猜想】
(2)猜想甲:Na₂CO₃适合作为抗酸药。其理由是______________________________(用化学方程式表示)。
猜想乙:Na₂CO₃不适合作为抗酸药。其原因可能是碱性较强。
【实验探究1】探究Na₂CO₃与NaHCO₃碱性的强弱
(3)依次测量等浓度的Na₂CO₃溶液和NaHCO₃溶液的pH,结果分别为11和9。Na₂CO₃溶液的碱性比NaHCO₃溶液__________(填“强”或“弱”)。
【实验探究2】探究Na₂CO₃作为抗酸药的适应性
先向500 mL烧杯中加入100 mL pH = 1.5的盐酸,用自动注射器向烧杯中以1 mL/min的速度滴入pH = 1.5的盐酸模拟人体分泌胃液,再加入1.0 g Na₂CO₃固体,并持续搅拌。用pH传感器记录溶液pH随时间的变化曲线。将上述实验中Na₂CO₃换成NaHCO₃,重复实验过程。所得两条曲线如下图所示。

【分析数据】
(4)由图可知,与NaHCO₃相比:①Na₂CO₃反应时造成胃液pH远大于5;②Na₂CO₃______________________________。
【得出结论】Na₂CO₃不适合作为抗酸药,猜想乙正确。
【反思评价】
(5)有小组成员提出,从控制变量和对比实验的角度看,“实验探究2”设计不够严谨,你认为不严谨之处是______________________________。
【拓展延伸】
(6)Al(OH)₃也是一种常用的抗酸药。从与胃酸反应的产物分析,相比Al(OH)₃,NaHCO₃抗酸药存在的不足是______________________________。
【查阅资料】
(1)①NaHCO₃俗称小苏打,Na₂CO₃俗称__________。
②人体胃液(含有盐酸)通常约100 mL,pH约1.5,体温约37 ℃。
③抗酸药的标准之一:药物发生疗效时,胃液的pH保持在3~5之间最宜,pH过高会导致胃痛等不适症状。
【提出猜想】
(2)猜想甲:Na₂CO₃适合作为抗酸药。其理由是______________________________(用化学方程式表示)。
猜想乙:Na₂CO₃不适合作为抗酸药。其原因可能是碱性较强。
【实验探究1】探究Na₂CO₃与NaHCO₃碱性的强弱
(3)依次测量等浓度的Na₂CO₃溶液和NaHCO₃溶液的pH,结果分别为11和9。Na₂CO₃溶液的碱性比NaHCO₃溶液__________(填“强”或“弱”)。
【实验探究2】探究Na₂CO₃作为抗酸药的适应性
先向500 mL烧杯中加入100 mL pH = 1.5的盐酸,用自动注射器向烧杯中以1 mL/min的速度滴入pH = 1.5的盐酸模拟人体分泌胃液,再加入1.0 g Na₂CO₃固体,并持续搅拌。用pH传感器记录溶液pH随时间的变化曲线。将上述实验中Na₂CO₃换成NaHCO₃,重复实验过程。所得两条曲线如下图所示。

【分析数据】
(4)由图可知,与NaHCO₃相比:①Na₂CO₃反应时造成胃液pH远大于5;②Na₂CO₃______________________________。
【得出结论】Na₂CO₃不适合作为抗酸药,猜想乙正确。
【反思评价】
(5)有小组成员提出,从控制变量和对比实验的角度看,“实验探究2”设计不够严谨,你认为不严谨之处是______________________________。
【拓展延伸】
(6)Al(OH)₃也是一种常用的抗酸药。从与胃酸反应的产物分析,相比Al(OH)₃,NaHCO₃抗酸药存在的不足是______________________________。
答案:
(1)纯碱(或苏打)
(2)Na₂CO₃ + 2HCl = 2NaCl + CO₂↑ + H₂O
(3)强
(4)使胃液pH>5的持续时间过长,会导致胃部不适
(5)实验没有模拟人体的温度
(6)与胃酸反应产生气体,可能造成胃胀
解析:
(2)碳酸钠与胃液中的盐酸反应生成氯化钠、水、二氧化碳。
(3)当pH大于7时,溶液呈碱性,比7越大,碱性越强,等浓度的Na₂CO₃溶液和NaHCO₃溶液的pH分别为11和9,故碳酸钠溶液碱性比碳酸氢钠溶液强。
(5)该实验模拟人体分泌胃液进行实验,实验没有模拟人体的温度。
(6)碳酸氢钠会与胃酸中的盐酸反应生成氯化钠、水、二氧化碳,产生气体会造成腹胀。
(1)纯碱(或苏打)
(2)Na₂CO₃ + 2HCl = 2NaCl + CO₂↑ + H₂O
(3)强
(4)使胃液pH>5的持续时间过长,会导致胃部不适
(5)实验没有模拟人体的温度
(6)与胃酸反应产生气体,可能造成胃胀
解析:
(2)碳酸钠与胃液中的盐酸反应生成氯化钠、水、二氧化碳。
(3)当pH大于7时,溶液呈碱性,比7越大,碱性越强,等浓度的Na₂CO₃溶液和NaHCO₃溶液的pH分别为11和9,故碳酸钠溶液碱性比碳酸氢钠溶液强。
(5)该实验模拟人体分泌胃液进行实验,实验没有模拟人体的温度。
(6)碳酸氢钠会与胃酸中的盐酸反应生成氯化钠、水、二氧化碳,产生气体会造成腹胀。
查看更多完整答案,请扫码查看


