第14页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
7. 新趋势 创新实验(2024·无锡一模)利用如图装置研究氢气的性质。向烧杯中加入约30 mL稀硫酸,5~7 s后将燃着的木条置于石英管口,观察到有火焰产生,一段时间后,观察到铜片由右向左逐渐变红,同时火焰明显变小。下列说法不正确的是 ( )
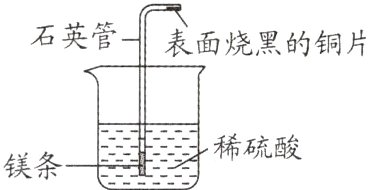
A. 该实验利用了铜的导热性
B. 该实验仅能证明氢气具有可燃性
C. 该实验点燃氢气前无需验纯
D. 该实验中共发生了3个化学反应

A. 该实验利用了铜的导热性
B. 该实验仅能证明氢气具有可燃性
C. 该实验点燃氢气前无需验纯
D. 该实验中共发生了3个化学反应
答案:
B 解析:铜片由右向左逐渐变红,说明氢气与氧化铜在加热条件下发生了反应,即该实验利用了铜的导热性,A正确;该实验除了能证明氢气具有可燃性,还能证明氢气具有还原性,B错误;5~7 s后将燃着的木条置于石英管口,由于导管很细,产生的氢气已将导管中的空气排出,该实验点燃氢气无需验纯,C正确;该实验中共发生了镁和稀硫酸反应生成硫酸镁和氢气、氢气燃烧生成水、氢气和氧化铜反应生成铜和水3个化学反应,D正确。
8. 新趋势 数字化实验 兴趣小组同学用相同形状的铁、镁、铝、锌四种金属分别和等浓度等体积的足量稀盐酸用如图1所示装置进行实验,反应过程中气压变化如图2所示。下列说法错误的是 ( )


A. 图2中①②对应的物质分别是锌和铁
B. 镁对应的气压变化中出现压强变小的原因是瓶中气体减少
C. 铝对应的气压变化,说明在实验前没有除去表面致密的氧化铝
D. 该实验能证明金属与盐酸反应的速率与金属的活动性有关


A. 图2中①②对应的物质分别是锌和铁
B. 镁对应的气压变化中出现压强变小的原因是瓶中气体减少
C. 铝对应的气压变化,说明在实验前没有除去表面致密的氧化铝
D. 该实验能证明金属与盐酸反应的速率与金属的活动性有关
答案:
B 解析:镁对应的气压变化中出现压强变小的原因是镁与稀盐酸反应放出热量,当温度恢复至室温后,分子之间间隔变小,导致压强变小,B错误。
9. 新趋势 创新实验(2024·泰州期末)使用耐热耐腐蚀材料封隔并固定V形管底部,向左、右两个支管中分别加入10 mL相同浓度的稀盐酸,再分别加入等质量锌粒和镁片,立即塞紧橡皮塞。实验装置(气密性良好)如图所示,下列说法错误的是 ( )
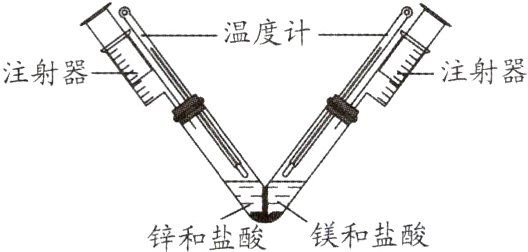
A. 两个支管内都观察到有气泡产生
B. 反应过程中观察到镁反应比锌剧烈
C. 实验过程中观察到温度计读数均升高
D. 若反应结束后镁和锌均有剩余,则两个注射器中收集到的气体体积:镁>锌

A. 两个支管内都观察到有气泡产生
B. 反应过程中观察到镁反应比锌剧烈
C. 实验过程中观察到温度计读数均升高
D. 若反应结束后镁和锌均有剩余,则两个注射器中收集到的气体体积:镁>锌
答案:
D 解析:锌和盐酸反应生成氯化锌和氢气,镁和盐酸反应生成氯化镁和氢气,所以两个支管内都观察到有气泡产生,A正确;镁的金属活动性强于锌,所以反应过程中观察到镁反应比锌剧烈,B正确;金属和酸反应过程中会放出热量,C正确;若反应结束后镁和锌均有剩余,所以盐酸全部反应,生成氢气的质量相等,收集到相同体积的气体,D错误。
10. (2024·广元中考)向一定量CuCl₂、FeCl₂混合溶液中加入一定量锌粉,充分反应后过滤,得到滤液和滤渣。下列说法正确的是 ( )
A. 若滤渣中只有一种金属,则滤液中除水以外的物质一定有三种
B. 若滤渣中有两种金属,则滤液中除水以外的物质一定有两种
C. 若滤液中只有一种除水以外的物质,则向滤渣中加入稀硫酸一定有气泡产生
D. 若滤液中有两种除水以外的物质,则向滤渣中加入稀硫酸不可能有气泡产生
A. 若滤渣中只有一种金属,则滤液中除水以外的物质一定有三种
B. 若滤渣中有两种金属,则滤液中除水以外的物质一定有两种
C. 若滤液中只有一种除水以外的物质,则向滤渣中加入稀硫酸一定有气泡产生
D. 若滤液中有两种除水以外的物质,则向滤渣中加入稀硫酸不可能有气泡产生
答案:
C 解析:金属活动性顺序为Zn>Fe>Cu,向一定量CuCl₂、FeCl₂的混合溶液中加入一定量锌粉,锌先与CuCl₂反应生成氯化锌和铜,CuCl₂反应完,若还有锌粉,锌才能与FeCl₂反应生成氯化锌和铁。若滤渣中只有一种金属,该金属是铜,此时若锌和氯化铜恰好完全反应,滤液中除水以外的物质有氯化亚铁、氯化锌两种,A错误;若滤渣中有两种金属,可能是铜和铁,滤液中除水以外的物质不一定有两种,也可能是锌和氯化亚铁恰好完全反应,此时滤液中除水以外的物质只有氯化锌一种,B错误;若滤液中只有一种溶质,滤渣中一定含有铁,此时向滤渣中加入稀硫酸,一定有气泡产生,C正确;若滤液中有两种除水以外的物质,说明除水以外的物质是氯化锌、氯化亚铁,若氯化亚铁部分参加了反应,滤渣中含有铜、铁,铁能与稀硫酸反应生成氢气,则向滤渣中加入稀硫酸有气泡产生,D错误。
11. (2023·开封一模)某金属粉末含有Mg、Zn、Fe中的一种或几种,取28 g该金属粉末与足量稀盐酸反应产生1 g氢气,则该金属粉末的组成不可能是下列中的 ( )
A. Fe
B. Mg、Zn
C. Zn、Fe
D. Mg、Zn、Fe
A. Fe
B. Mg、Zn
C. Zn、Fe
D. Mg、Zn、Fe
答案:
C 解析:设生成1 g氢气,消耗镁的质量为x,消耗锌的质量为y,消耗铁的质量为z。
Mg + 2HCl == MgCl₂ + H₂↑
24 2
x 1 g
$\frac{24}{2}=\frac{x}{1g}$ x = 12 g
Zn + 2HCl == ZnCl₂ + H₂↑
65 2
y 1 g
$\frac{65}{2}=\frac{y}{1g}$ y = 32.5 g
Fe + 2HCl == FeCl₂ + H₂↑
56 2
z 1 g
$\frac{56}{2}=\frac{z}{1g}$ z = 28 g
根据题意可知,28 g该金属粉末与足量稀盐酸反应产生1 g氢气,故金属组成可能有:①Fe;②Mg、Zn;③Mg、Zn、Fe,共三种可能。
Mg + 2HCl == MgCl₂ + H₂↑
24 2
x 1 g
$\frac{24}{2}=\frac{x}{1g}$ x = 12 g
Zn + 2HCl == ZnCl₂ + H₂↑
65 2
y 1 g
$\frac{65}{2}=\frac{y}{1g}$ y = 32.5 g
Fe + 2HCl == FeCl₂ + H₂↑
56 2
z 1 g
$\frac{56}{2}=\frac{z}{1g}$ z = 28 g
根据题意可知,28 g该金属粉末与足量稀盐酸反应产生1 g氢气,故金属组成可能有:①Fe;②Mg、Zn;③Mg、Zn、Fe,共三种可能。
12. (2024·安徽模拟)某化学兴趣小组以“金属的化学性质”为主题开展项目式学习。
【任务一】金属与氧气反应

(1)按图1进行实验(夹持装置已省略),打开分液漏斗,几分钟后观察到:A处铁丝依然光亮,B处铁丝表面灰暗,C处铁丝依然光亮。下列有关铁丝锈蚀的说法中正确的是______(填序号)。
①A、B处实验现象对比,可得出铁生锈与氧气有关
②A、C处实验现象对比,可得出铁生锈与水有关
③B、C处实验现象对比说明:铁生锈快慢与氧气浓度有关
【任务二】金属与酸反应
比较金属活动性:取过量的表面积相同的锌粒与铁粒、铝丝与锌丝,分别加入等浓度等体积的稀盐酸,用温度传感器测定上述四个反应过程中的溶液温度变化曲线如图2所示。

(2)写出铝与稀盐酸反应的化学方程式:______,该反应溶液温度先升高后下降的原因是______。
(3)由图2分析可知,金属的活动性强弱与反应时溶液温度变化的关系是______。
【任务三】金属和盐溶液的反应
查阅资料:金属与两种盐溶液反应时,活动性更弱的金属优先被置换出来。
(4)化学小组活动中,同学们在实验室将一定量锌粒加入含有Fe(NO₃)₂和Cu(NO₃)₂的溶液中,充分反应后,过滤得到浅绿色滤液A和滤渣B。则滤液A中一定含有的溶质是______。
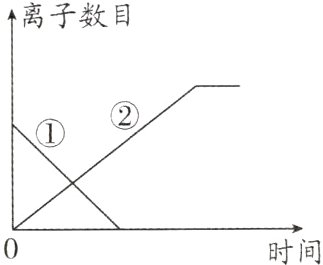
(5)下图是同学们绘制出的加入锌粒时溶液中阳离子个数随时间变化的图像。②代表的离子是______。
(6)已知加入锌粒前溶液中Fe²⁺和Cu²⁺数目相同,请在图中画出加入过量锌粒后Fe²⁺数目的变化图像。
【任务一】金属与氧气反应

(1)按图1进行实验(夹持装置已省略),打开分液漏斗,几分钟后观察到:A处铁丝依然光亮,B处铁丝表面灰暗,C处铁丝依然光亮。下列有关铁丝锈蚀的说法中正确的是______(填序号)。
①A、B处实验现象对比,可得出铁生锈与氧气有关
②A、C处实验现象对比,可得出铁生锈与水有关
③B、C处实验现象对比说明:铁生锈快慢与氧气浓度有关
【任务二】金属与酸反应
比较金属活动性:取过量的表面积相同的锌粒与铁粒、铝丝与锌丝,分别加入等浓度等体积的稀盐酸,用温度传感器测定上述四个反应过程中的溶液温度变化曲线如图2所示。

(2)写出铝与稀盐酸反应的化学方程式:______,该反应溶液温度先升高后下降的原因是______。
(3)由图2分析可知,金属的活动性强弱与反应时溶液温度变化的关系是______。
【任务三】金属和盐溶液的反应
查阅资料:金属与两种盐溶液反应时,活动性更弱的金属优先被置换出来。
(4)化学小组活动中,同学们在实验室将一定量锌粒加入含有Fe(NO₃)₂和Cu(NO₃)₂的溶液中,充分反应后,过滤得到浅绿色滤液A和滤渣B。则滤液A中一定含有的溶质是______。
(5)下图是同学们绘制出的加入锌粒时溶液中阳离子个数随时间变化的图像。②代表的离子是______。
(6)已知加入锌粒前溶液中Fe²⁺和Cu²⁺数目相同,请在图中画出加入过量锌粒后Fe²⁺数目的变化图像。

答案:
(1)③
(2)2Al + 6HCl == 2AlCl₃ + 3H₂↑ 铝和盐酸反应属于放热反应,至恰好完全反应时温度最高,继续加入的稀盐酸起冷却降温作用,热量逐渐散失(合理即可)
(3)越活泼的金属放出的热量越多,温度升高得越快(合理即可)
(4)硝酸亚铁和硝酸锌
(5)锌离子
(6)
解析:
(3)由图2分析可知,金属的活动性强弱与反应时溶液温度的关系是,其他条件相同时,金属越活泼,溶液温度变化幅度越大。
(4)金属活动性:Zn>Fe>Cu,将一定量的锌粉加入Fe(NO₃)₂和Cu(NO₃)₂的混合溶液中,锌先与硝酸铜反应生成铜和硝酸锌,待硝酸铜反应完全后,再与硝酸亚铁反应生成铁和硝酸锌;充分反应后过滤,得到滤液和滤渣,滤液呈浅绿色,说明一定含有硝酸亚铁,硝酸亚铁可能未反应,也可能部分参与反应,则滤渣中一定含有铜,滤液中一定含有硝酸亚铁和硝酸锌,无法判断是否含有硝酸铜。
(5)锌先与硝酸铜反应,生成铜和硝酸锌,待硝酸铜反应完全后,再与硝酸亚铁反应生成铁和硝酸锌,②代表的离子个数是从0开始逐渐增多最后不变,故代表的是锌离子。
(6)锌先与硝酸铜反应,生成铜和硝酸锌,待硝酸铜反应完全后,再与硝酸亚铁反应生成铁和硝酸锌;所以加入锌后,铜离子个数先减少,亚铁离子个数不变,当硝酸铜完全反应后,亚铁离子开始减少,到锌和硝酸亚铁恰好反应时,亚铁离子个数为0,如图:
 曲线③代表Fe²⁺。
曲线③代表Fe²⁺。
(1)③
(2)2Al + 6HCl == 2AlCl₃ + 3H₂↑ 铝和盐酸反应属于放热反应,至恰好完全反应时温度最高,继续加入的稀盐酸起冷却降温作用,热量逐渐散失(合理即可)
(3)越活泼的金属放出的热量越多,温度升高得越快(合理即可)
(4)硝酸亚铁和硝酸锌
(5)锌离子
(6)

解析:
(3)由图2分析可知,金属的活动性强弱与反应时溶液温度的关系是,其他条件相同时,金属越活泼,溶液温度变化幅度越大。
(4)金属活动性:Zn>Fe>Cu,将一定量的锌粉加入Fe(NO₃)₂和Cu(NO₃)₂的混合溶液中,锌先与硝酸铜反应生成铜和硝酸锌,待硝酸铜反应完全后,再与硝酸亚铁反应生成铁和硝酸锌;充分反应后过滤,得到滤液和滤渣,滤液呈浅绿色,说明一定含有硝酸亚铁,硝酸亚铁可能未反应,也可能部分参与反应,则滤渣中一定含有铜,滤液中一定含有硝酸亚铁和硝酸锌,无法判断是否含有硝酸铜。
(5)锌先与硝酸铜反应,生成铜和硝酸锌,待硝酸铜反应完全后,再与硝酸亚铁反应生成铁和硝酸锌,②代表的离子个数是从0开始逐渐增多最后不变,故代表的是锌离子。
(6)锌先与硝酸铜反应,生成铜和硝酸锌,待硝酸铜反应完全后,再与硝酸亚铁反应生成铁和硝酸锌;所以加入锌后,铜离子个数先减少,亚铁离子个数不变,当硝酸铜完全反应后,亚铁离子开始减少,到锌和硝酸亚铁恰好反应时,亚铁离子个数为0,如图:
 曲线③代表Fe²⁺。
曲线③代表Fe²⁺。 查看更多完整答案,请扫码查看


