第51页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
9. 新趋势 跨学科融合(2024·安康三模)将粉末状白色硫酸铜晶体(CuSO₄)加入盛有100 mL 60℃热水的烧杯中,直至不能继续溶解为止,得到该温度下的蓝色溶液M,接着将一小块蓝色硫酸铜晶体(CuSO₄·5H₂O)浸入烧杯中的硫酸铜溶液中(如图所示),自然冷却至室温,观察现象(已知:硫酸铜的溶解度随温度的降低而减小)。下列有关该实验的描述中,不合理的是( )

A. 60℃时,蓝色溶液M是硫酸铜的饱和溶液
B. 随着温度的降低,硫酸铜溶液的质量不断减少
C. 冷却至室温后,此时溶液为该温度下的不饱和溶液
D. 在降温过程中,小块硫酸铜晶体N逐渐变大

A. 60℃时,蓝色溶液M是硫酸铜的饱和溶液
B. 随着温度的降低,硫酸铜溶液的质量不断减少
C. 冷却至室温后,此时溶液为该温度下的不饱和溶液
D. 在降温过程中,小块硫酸铜晶体N逐渐变大
答案:
C 解析:将粉末状白色硫酸铜晶体(CuSO₄)加入盛有100mL60℃热水的烧杯中,直至不能继续溶解为止,得到该温度下的蓝色溶液M,因为固体不再溶解,所以M是硫酸铜的饱和溶液,A正确;由于硫酸铜的溶解度随温度的降低而减小,所以随着温度的降低,溶液M中会有晶体析出,即随着温度的降低,硫酸铜溶液的质量不断减少,B正确;由于硫酸铜的溶解度随温度的降低而减小,将一小块蓝色硫酸铜晶体(CuSO₄·5H₂O)浸入烧杯中的硫酸铜溶液中,自然冷却至室温,随着温度的降低,溶液M中会有晶体析出,此时溶液仍为该温度下的饱和溶液,C错误;由于硫酸铜的溶解度随温度的降低而减小,将一小块蓝色硫酸铜晶体(CuSO₄·5H₂O)浸入烧杯中的硫酸铜溶液中,自然冷却至室温,随着温度的降低,溶液M中会有晶体析出,小块硫酸铜晶体N质量逐渐变大,D正确。
10. 有w g溶质质量分数为10%的硝酸钾溶液,若将其溶质质量分数变为20%,可以采用的方法是( )
A. 蒸发掉溶剂的$\frac{1}{2}$
B. 加入$\frac{3}{20}w$ g的硝酸钾
C. 蒸发掉$\frac{w}{2}$ g溶剂
D. 加入$\frac{5}{14}w$ g的硝酸钾
A. 蒸发掉溶剂的$\frac{1}{2}$
B. 加入$\frac{3}{20}w$ g的硝酸钾
C. 蒸发掉$\frac{w}{2}$ g溶剂
D. 加入$\frac{5}{14}w$ g的硝酸钾
答案:
C 解析:设需要蒸发水的质量为x,(wg−x)×20%=wg×10%,x=$\frac{w}{2}$g,应将溶剂蒸发掉溶液质量的一半,而不是溶剂质量的一半,A错误,C正确;设需要加入硝酸钾的质量为y,(wg+y)×20%=wg×10%+y,y=$\frac{w}{8}$g,应加入$\frac{w}{8}$g的硝酸钾,B、D错误。
11. 思想方法 对比法(2023·盐城模拟)对室温下的100 g饱和硫酸铜溶液,按如图所示流程进行操作后,得到烧杯甲和烧杯乙(均为室温),已知,硫酸铜粉末中不含结晶水,硫酸铜晶体中含有结晶水,有关烧杯甲和烧杯乙物质间关系判断正确的是( )
转移50g溶液 加m g硫酸铜粉末 烧杯甲
100g饱和硫酸铜溶液
加m g硫酸铜晶体 烧杯乙
A. 溶质质量:甲 = 乙
B. 溶剂质量:甲 = 乙
C. 溶液质量:甲 < 乙
D. 溶质质量分数:甲 > 乙
转移50g溶液 加m g硫酸铜粉末 烧杯甲
100g饱和硫酸铜溶液
加m g硫酸铜晶体 烧杯乙
A. 溶质质量:甲 = 乙
B. 溶剂质量:甲 = 乙
C. 溶液质量:甲 < 乙
D. 溶质质量分数:甲 > 乙
答案:
C 解析:将室温下的100g饱和硫酸铜溶液分成两份50g的溶液,溶液的性质没有发生变化,依然是两份饱和的硫酸铜溶液,在甲中加入mg硫酸铜粉末,硫酸铜粉末不会溶解;在乙中加入mg硫酸铜晶体,由于硫酸铜晶体中含有结晶水,溶于水中后会分解出水分子,因此乙中硫酸铜晶体会溶解一部分,所以乙溶液的质量大于甲溶液的质量,乙的溶剂质量也大于甲的溶剂质量;两份溶液的温度相同,所以溶质质量分数也相同。故选C。
12.(2023·镇江期末)向400.0 g CuSO₄的溶液中先逐渐加入一定量的锌粉,再逐渐加入铁粉,测得剩余固体质量与加入金属的质量关系如图所示。下列说法正确的是( )
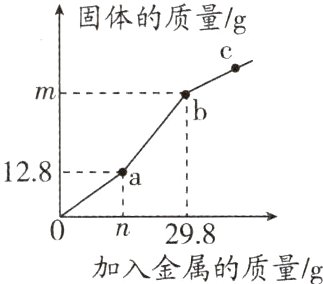
A. a点对应的溶液为无色
B. n = 13,m = 19.2
C. c点对应的固体中加稀盐酸,有气泡产生
D. 原溶液中CuSO₄的溶质质量分数为16.0%

A. a点对应的溶液为无色
B. n = 13,m = 19.2
C. c点对应的固体中加稀盐酸,有气泡产生
D. 原溶液中CuSO₄的溶质质量分数为16.0%
答案:
C 解析:向硫酸铜中加一定量的锌粉,锌和硫酸铜反应生成硫酸锌和铜,再加入铁粉,铁和硫酸锌不反应,铁和硫酸铜反应生成硫酸亚铁和铜,图中出现2个转折点,0~a段表示锌和硫酸铜反应,a点表示锌刚好消耗完,a~b段表示铁和硫酸铜反应,b点表示硫酸铜刚好反应完,故a点含有硫酸铜,对应的溶液为蓝色,A错误;a点时,剩余固体为反应生成的铜,此时铜的质量为12.8g,锌和硫酸铜反应生成硫酸锌和铜,设反应的锌的质量为x,
Zn+CuSO₄=ZnSO₄+Cu
65 64
x 12.8g
$\frac{65}{64}$=$\frac{x}{12.8g}$,x=13g
即n=13;a~b段表示铁和硫酸铜反应,b点表示硫酸铜刚好反应完,设铁和硫酸铜反应生成铜的质量为y,
Fe+CuSO₄=FeSO₄+Cu
56 64
29.8g−13g y
$\frac{56}{64}$=$\frac{29.8g−13g}{y}$,y=19.2g
则m=12.8+19.2=32,B错误;c点对应的固体中有铁和铜,加稀盐酸,铁和盐酸反应生成氯化亚铁和氢气,有气泡产生,C正确;生成的铜的质量为32g,铜元素来自硫酸铜,故硫酸铜的质量为32g÷($\frac{64}{64 + 32 + 16×4}$×100%) = 80g,故原溶液中CuSO₄的溶质质量分数为$\frac{80g}{400.0g}$×100%=20%,D错误。
Zn+CuSO₄=ZnSO₄+Cu
65 64
x 12.8g
$\frac{65}{64}$=$\frac{x}{12.8g}$,x=13g
即n=13;a~b段表示铁和硫酸铜反应,b点表示硫酸铜刚好反应完,设铁和硫酸铜反应生成铜的质量为y,
Fe+CuSO₄=FeSO₄+Cu
56 64
29.8g−13g y
$\frac{56}{64}$=$\frac{29.8g−13g}{y}$,y=19.2g
则m=12.8+19.2=32,B错误;c点对应的固体中有铁和铜,加稀盐酸,铁和盐酸反应生成氯化亚铁和氢气,有气泡产生,C正确;生成的铜的质量为32g,铜元素来自硫酸铜,故硫酸铜的质量为32g÷($\frac{64}{64 + 32 + 16×4}$×100%) = 80g,故原溶液中CuSO₄的溶质质量分数为$\frac{80g}{400.0g}$×100%=20%,D错误。
二、填空题(本大题共3小题,共38分)
13.(13分)溶液在日常生活、工农业生产和科学研究中具有广泛的用途。
(1)生理盐水是医疗上常用的一种溶液,其溶质是__________(填化学式)。
(2)在盛有水的烧杯中加入以下某种物质,形成溶液的过程中温度上升。这种物质是________(填字母)。
A. 氯化钠
B. 硝酸
C. 氢氧化钠
(3)如图是一瓶刚开启的“XX牌”碳酸饮料的示意图。请回答:

①该饮料属于________(填“纯净物”或“混合物”)。
②开启时,大量的气泡从罐内冒出,说明随着压强的减小,气体的溶解度________(填“增大”或“减小”)。
③喝了这种饮料,容易打嗝是因为____________________。
(4)某注射用药液的配制方法如下:
①把1.0 g药品溶于水配制成4.0 mL溶液a;
②取0.1 mL溶液a,加水稀释至1.0 mL,得溶液b;
③取0.1 mL溶液b,加水稀释至1.0 mL,得溶液c;
④取0.4 mL溶液c,加水稀释至1.0 mL,得溶液d。
由于在整个配制过程中药液很稀,其密度都可近似看作1 g/cm³。则最终得到的药液(溶液d)中溶质的质量分数为________。
13.(13分)溶液在日常生活、工农业生产和科学研究中具有广泛的用途。
(1)生理盐水是医疗上常用的一种溶液,其溶质是__________(填化学式)。
(2)在盛有水的烧杯中加入以下某种物质,形成溶液的过程中温度上升。这种物质是________(填字母)。
A. 氯化钠
B. 硝酸
C. 氢氧化钠
(3)如图是一瓶刚开启的“XX牌”碳酸饮料的示意图。请回答:

①该饮料属于________(填“纯净物”或“混合物”)。
②开启时,大量的气泡从罐内冒出,说明随着压强的减小,气体的溶解度________(填“增大”或“减小”)。
③喝了这种饮料,容易打嗝是因为____________________。
(4)某注射用药液的配制方法如下:
①把1.0 g药品溶于水配制成4.0 mL溶液a;
②取0.1 mL溶液a,加水稀释至1.0 mL,得溶液b;
③取0.1 mL溶液b,加水稀释至1.0 mL,得溶液c;
④取0.4 mL溶液c,加水稀释至1.0 mL,得溶液d。
由于在整个配制过程中药液很稀,其密度都可近似看作1 g/cm³。则最终得到的药液(溶液d)中溶质的质量分数为________。
答案:
(1)NaCl
(2)C
(3)①混合物 ②减小 ③体内的温度高,二氧化碳的溶解度变小
(4)0.1%
(1)NaCl
(2)C
(3)①混合物 ②减小 ③体内的温度高,二氧化碳的溶解度变小
(4)0.1%
查看更多完整答案,请扫码查看


