第18页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
例1 (2024·安阳模拟预测)在密闭容器中分别放入打磨过的等质量的镁片、铁片、锌片和等体积、等浓度的足量稀硫酸,用压强传感器测得容器内气体压强与反应时间的变化曲线如图所示。下列有关说法不正确的是 ( )
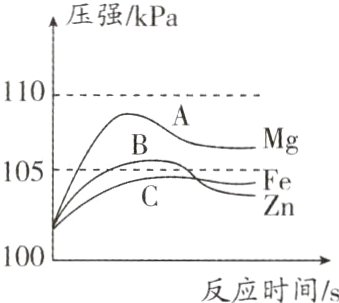
A. 三种金属的活动性:Mg>Zn>Fe
B. 三种金属消耗硫酸的质量:Mg>Zn>Fe
C. 三种金属最终产生气体的质量:Mg>Fe>Zn
D. 该实验中放热现象的明显程度:Zn>Fe

A. 三种金属的活动性:Mg>Zn>Fe
B. 三种金属消耗硫酸的质量:Mg>Zn>Fe
C. 三种金属最终产生气体的质量:Mg>Fe>Zn
D. 该实验中放热现象的明显程度:Zn>Fe
答案:
B 解析:消耗98g硫酸时,消耗镁、铁、锌的质量分别是24g、56g、65g,三种金属消耗硫酸的质量:Mg>Fe>Zn,B错误。
变式训练
1. 镁、铝、铁为生活中常见的金属,它们都能与盐酸反应生成氢气。将三种金属分别与相同浓度的稀盐酸反应。下列有关变化趋势的图像合理的是 ( )

A. 向等质量的镁、铝、铁中分别加入足量的稀盐酸
B. 向等质量的稀盐酸中加入足量的镁、铝、铁
C. 向等质量的镁、铝、铁中分别加入足量的稀盐酸
D. 将足量的镁、铝、铁加入等质量的稀盐酸中
1. 镁、铝、铁为生活中常见的金属,它们都能与盐酸反应生成氢气。将三种金属分别与相同浓度的稀盐酸反应。下列有关变化趋势的图像合理的是 ( )

A. 向等质量的镁、铝、铁中分别加入足量的稀盐酸
B. 向等质量的稀盐酸中加入足量的镁、铝、铁
C. 向等质量的镁、铝、铁中分别加入足量的稀盐酸
D. 将足量的镁、铝、铁加入等质量的稀盐酸中
答案:
B
例2 (2024·齐齐哈尔中考)将一定质量的铁粉放入硝酸锌和硝酸银的混合溶液中,充分反应后过滤,得到滤渣和滤液。下列说法正确的是 ( )
A. 若滤液呈浅绿色,则滤液中只含有硝酸亚铁
B. 若滤渣中的成分能被磁铁吸引,则滤渣中一定含有两种金属
C. 若向滤液中加入锌片,有固体析出,则滤液中一定含有硝酸银
D. 将所得滤渣洗涤、干燥后称量,质量可能与所加铁粉的质量相等
A. 若滤液呈浅绿色,则滤液中只含有硝酸亚铁
B. 若滤渣中的成分能被磁铁吸引,则滤渣中一定含有两种金属
C. 若向滤液中加入锌片,有固体析出,则滤液中一定含有硝酸银
D. 将所得滤渣洗涤、干燥后称量,质量可能与所加铁粉的质量相等
答案:
B 解析:若滤液呈浅绿色,由于不确定硝酸银是否完全反应,则滤液中一定含有硝酸锌和硝酸亚铁,可能含有硝酸银,A错误;若滤渣中的成分能被磁铁吸引,则说明铁过量,则滤渣中含有银和铁,B正确;由于锌能和硝酸亚铁反应生成铁和硝酸锌,则向滤液中加入锌片,一定有固体析出,则不能说明滤液中是否含有硝酸银,C错误;由于Fe + 2AgNO₃ = Fe(NO₃)₂ + 2Ag,反应后固体质量增大,则所得滤渣的质量比所加铁粉质量大,D错误。
变式训练
2.(2023·常德期中)某电镀厂为减少水污染及节约成本,从含有CuSO₄、ZnSO₄、FeSO₄的废水中回收ZnSO₄和有关金属,有关该实验流程分析不正确的是 ( )
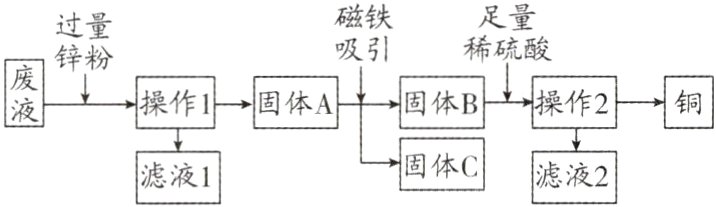
A. “操作1”和“操作2”的名称是过滤
B. 固体A的成分是Cu、Fe、Zn
C. 废液的质量大于滤液1的质量
D. 滤液1和滤液2中均含有ZnSO₄
2.(2023·常德期中)某电镀厂为减少水污染及节约成本,从含有CuSO₄、ZnSO₄、FeSO₄的废水中回收ZnSO₄和有关金属,有关该实验流程分析不正确的是 ( )

A. “操作1”和“操作2”的名称是过滤
B. 固体A的成分是Cu、Fe、Zn
C. 废液的质量大于滤液1的质量
D. 滤液1和滤液2中均含有ZnSO₄
答案:
C 解析:金属活动性:Zn>Fe>Cu,所以向废液中加入过量的锌粉,锌能与硫酸铜、硫酸亚铁发生反应,由Zn + CuSO₄ = ZnSO₄ + Cu和Zn + FeSO₄ = ZnSO₄ + Fe可知,每65份质量的锌可置换出64份质量的铜,每65份质量的锌可置换出56份质量的铁,反应后溶液质量增加,故废液的质量小于滤液1的质量,C错误。
例3 (2022·滨州中考)如图所示是模拟工业炼铁的化学反应装置,以下说法错误的是( )

A. 实验开始时应先通入一氧化碳,目的是排净硬质玻璃管内的空气,防止爆炸
B. 硬质玻璃管内氧化铁发生还原反应
C. 实验过程中硬质玻璃管内观察到的现象是黑色粉末逐渐变成红色
D. 装置中导管末端加一点燃的酒精灯,目的是燃烧未反应的一氧化碳,防止污染环境

A. 实验开始时应先通入一氧化碳,目的是排净硬质玻璃管内的空气,防止爆炸
B. 硬质玻璃管内氧化铁发生还原反应
C. 实验过程中硬质玻璃管内观察到的现象是黑色粉末逐渐变成红色
D. 装置中导管末端加一点燃的酒精灯,目的是燃烧未反应的一氧化碳,防止污染环境
答案:
C 解析:由于氧化铁是红色,铁粉是黑色,则硬质玻璃管内的现象是红色粉末变黑色,C错误。
查看更多完整答案,请扫码查看


