第65页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
6.(2024·苏州月考)常温下,将10 g 5%稀盐酸逐滴加入盛有5 g 5% NaOH溶液(含2滴酚酞)的锥形瓶中,边滴边振荡。下列有关说法正确的是 ( )
A. 滴加过程中,锥形瓶内溶液中Na⁺的数目不断增加
B. 滴加过程中,溶液恰好由无色变为红色时,溶液pH为7
C. 滴加过程中,锥形瓶内溶液温度不断升高
D. 滴加结束后,取少量溶液蒸干,所得白色固体是NaCl
A. 滴加过程中,锥形瓶内溶液中Na⁺的数目不断增加
B. 滴加过程中,溶液恰好由无色变为红色时,溶液pH为7
C. 滴加过程中,锥形瓶内溶液温度不断升高
D. 滴加结束后,取少量溶液蒸干,所得白色固体是NaCl
答案:
D 解析:常温下,将10 g 5%稀盐酸逐滴加入盛有5 g 5% NaOH溶液(含2滴酚酞)的锥形瓶中,氢氧化钠和盐酸反应生成氯化钠和水,滴加过程中,锥形瓶内溶液中Na⁺的数目不变,A错误;NaOH溶液显碱性,开始时溶液为红色,滴加过程中,溶液恰好由红色变为无色时,溶液显中性,溶液pH = 7,B错误;中和反应属于放热反应,滴加至恰好完全反应时,锥形瓶内溶液温度不断升高,恰好完全反应后,继续滴加稀盐酸,溶液的温度会降低,C错误;根据稀盐酸和氢氧化钠反应的量比关系$\frac{HCl}{36.5}$~$\frac{NaOH}{40}$,将10 g 5%稀盐酸逐滴加入盛有5 g 5% NaOH溶液(含2滴酚酞)的锥形瓶中,边滴边振荡,可知稀盐酸有剩余,所以滴加结束后,取少量溶液蒸干,过量的稀盐酸会挥发出氯化氢气体,最终所得白色固体一定是NaCl,D正确。
7.(2023·包头中考)常温下向一定量的稀盐酸中逐滴加入氢氧化钠溶液至过量,测得水的质量、氯化钠的质量随氢氧化钠溶液质量的变化关系如图所示。下列说法错误的是 ( )
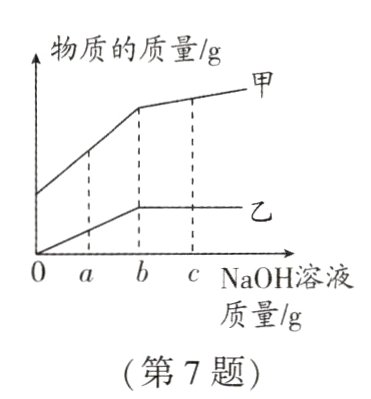
A. 乙表示的物质为氯化钠
B. 加入b g NaOH溶液时,恰好完全反应
C. 加入c g NaOH溶液时,所得溶液中的阴离子为Cl⁻
D. NaOH溶液质量由a g增加到b g,所得溶液的酸性逐渐减弱

A. 乙表示的物质为氯化钠
B. 加入b g NaOH溶液时,恰好完全反应
C. 加入c g NaOH溶液时,所得溶液中的阴离子为Cl⁻
D. NaOH溶液质量由a g增加到b g,所得溶液的酸性逐渐减弱
答案:
C 解析:由于稀盐酸中含有水,则最开始水的质量不为零,则甲表示水的质量,乙表示氯化钠的质量,A正确;由图可知,加入b g氢氧化钠时,氯化钠质量不再变化,表示此时恰好完全反应,B正确;加入c g氢氧化钠时,氢氧化钠过量,此时溶液中的溶质为氢氧化钠和氯化钠,则其中的阴离子为OH⁻和Cl⁻,C错误;氢氧化钠溶液质量由a g增加到b g,溶液中的盐酸不断减少,则溶液的酸性逐渐减弱,D正确。
8.(2024·南京一模)取三份相同体积相同浓度的氢氧化钠溶液,分别滴入两滴无色酚酞溶液,再以相同的速度同时滴加不同浓度的盐酸,得到溶液的pH随时间变化的曲线如图所示,下列有关说法不正确的是 ( )
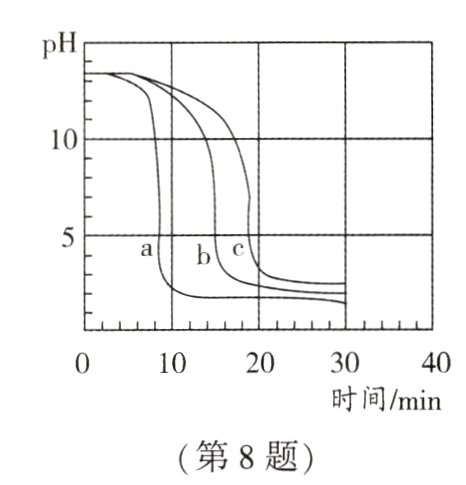
A. 在a、b、c三种曲线所示的实验中,所用盐酸的浓度由大到小的顺序为a>b>c
B. 溶液红色最先褪去的是c
C. 20 min时,溶液的酸性由强到弱的顺序为a>b>c
D. 20 min时,溶液中存在的离子主要是Na⁺、Cl⁻、H⁺

A. 在a、b、c三种曲线所示的实验中,所用盐酸的浓度由大到小的顺序为a>b>c
B. 溶液红色最先褪去的是c
C. 20 min时,溶液的酸性由强到弱的顺序为a>b>c
D. 20 min时,溶液中存在的离子主要是Na⁺、Cl⁻、H⁺
答案:
B 解析:氯化氢和氢氧化钠反应生成氯化钠和水,氯化钠溶液为中性,三份相同体积相同浓度的氢氧化钠溶液,再以相同的速度同时滴加不同浓度的盐酸,pH下降越快,盐酸的浓度越大,故所用盐酸的浓度由大到小的顺序为a>b>c,A正确;无色酚酞溶液在碱性溶液中变红,在中性和酸性溶液中不变色,由图可知,a的反应速率最快,a中pH最先达到7,因此溶液红色最先褪去的是a,B错误;由图可知:20 min时三种溶液的pH为a<b<c,因此溶液的酸性由强到弱的顺序是a>b>c,C正确;20 min时,三份溶液的pH均小于7,说明此时盐酸过量,氢氧化钠和氯化氢反应生成氯化钠和水,因此此时溶液中的溶质均是NaCl和HCl,则溶液中存在的离子主要是Na⁺、Cl⁻、H⁺,D正确。
9.(2024·连云港模拟)中和反应在日常生活和工农业生产中有广泛的应用。某小组在实验室探究氢氧化钠和盐酸的反应。
(1)向盛有5 mL氢氧化钠溶液的烧杯中滴加几滴酚酞溶液,可观察到________的现象。再向其中滴入稀盐酸,溶液变无色。学生对于所加盐酸是否过量提出了疑问,于是对反应后溶液中溶质的成分作出猜想:
猜想一:NaCl 猜想二:NaCl、HCl
(2)为了验证其猜想,同学们进行如下探究。
|实验操作|实验现象|实验结论|
|----|----|----|
|取少量反应后的溶液,加入镁条|________|猜想二正确,证明盐酸过量|

(3)向氢氧化钠溶液中滴加稀盐酸时,有同学触摸试管外壁,感觉有温度变化。小组同学利用数字传感器得出反应时间与溶液温度变化的关系,如图所示。

同学们得出结论:稀盐酸和氢氧化钠反应过程中____________________。
(4)查阅资料得知,在中和反应中溶液的导电性也发生变化。已知电导率是衡量溶液导电能力大小的物理量。在相同条件下,电导率与离子浓度(单位体积内的离子数)成正比。

①P点溶液中单位体积内离子数______N点(填“>”“<”或“=”)。
②M点表示____________________。
【交流与反思】
a. 中和反应发生的实质是____________________。
b. 中和反应可以从热量、酸碱性、产物、导电性等方面进行探究。
(1)向盛有5 mL氢氧化钠溶液的烧杯中滴加几滴酚酞溶液,可观察到________的现象。再向其中滴入稀盐酸,溶液变无色。学生对于所加盐酸是否过量提出了疑问,于是对反应后溶液中溶质的成分作出猜想:
猜想一:NaCl 猜想二:NaCl、HCl
(2)为了验证其猜想,同学们进行如下探究。
|实验操作|实验现象|实验结论|
|----|----|----|
|取少量反应后的溶液,加入镁条|________|猜想二正确,证明盐酸过量|

(3)向氢氧化钠溶液中滴加稀盐酸时,有同学触摸试管外壁,感觉有温度变化。小组同学利用数字传感器得出反应时间与溶液温度变化的关系,如图所示。

同学们得出结论:稀盐酸和氢氧化钠反应过程中____________________。
(4)查阅资料得知,在中和反应中溶液的导电性也发生变化。已知电导率是衡量溶液导电能力大小的物理量。在相同条件下,电导率与离子浓度(单位体积内的离子数)成正比。

①P点溶液中单位体积内离子数______N点(填“>”“<”或“=”)。
②M点表示____________________。
【交流与反思】
a. 中和反应发生的实质是____________________。
b. 中和反应可以从热量、酸碱性、产物、导电性等方面进行探究。
答案:
(1)溶液变红 (2)有气泡产生 (3)放出热量 (4)①= ②恰好完全反应(或单位体积内离子数最少)(合理即可)
【交流与反思】酸中的氢离子和碱中的氢氧根离子结合成水(符号表示亦可)
解析:(2)由结论知,猜想二正确,证明盐酸过量,则取少量反应后的溶液,加入镁条,镁与盐酸反应生成氯化镁和氢气,可观察到有气泡产生。(3)由图像知,向氢氧化钠溶液中滴加稀盐酸,一段时间内,溶液的温度升高,说明盐酸和氢氧化钠反应过程中放出热量。(4)①由图像知,P点与N点电导率相同,所以N点时溶液中单位体积内的离子数等于P点时溶液中单位体积内的离子数;②由图像知,M点电导率最低,说明M点时溶液中单位体积内的离子数最少;氢氧化钠和盐酸恰好完全反应时生成氯化钠和水,水以分子形式存在,即单位体积内的离子数最少,M点时单位体积内的离子数最少,表示此时恰好完全反应。【交流与反思】氢氧化钠溶液中含有钠离子、氢氧根离子和水分子,稀盐酸中含有氢离子、氯离子和水分子,氢氧化钠和盐酸发生中和反应生成氯化钠和水,此时溶液中含有钠离子、氯离子和水分子,则中和反应发生的实质是酸中的氢离子和碱中的氢氧根离子结合成水。
【交流与反思】酸中的氢离子和碱中的氢氧根离子结合成水(符号表示亦可)
解析:(2)由结论知,猜想二正确,证明盐酸过量,则取少量反应后的溶液,加入镁条,镁与盐酸反应生成氯化镁和氢气,可观察到有气泡产生。(3)由图像知,向氢氧化钠溶液中滴加稀盐酸,一段时间内,溶液的温度升高,说明盐酸和氢氧化钠反应过程中放出热量。(4)①由图像知,P点与N点电导率相同,所以N点时溶液中单位体积内的离子数等于P点时溶液中单位体积内的离子数;②由图像知,M点电导率最低,说明M点时溶液中单位体积内的离子数最少;氢氧化钠和盐酸恰好完全反应时生成氯化钠和水,水以分子形式存在,即单位体积内的离子数最少,M点时单位体积内的离子数最少,表示此时恰好完全反应。【交流与反思】氢氧化钠溶液中含有钠离子、氢氧根离子和水分子,稀盐酸中含有氢离子、氯离子和水分子,氢氧化钠和盐酸发生中和反应生成氯化钠和水,此时溶液中含有钠离子、氯离子和水分子,则中和反应发生的实质是酸中的氢离子和碱中的氢氧根离子结合成水。
查看更多完整答案,请扫码查看


