2025年初中实验探究报告册九年级化学全一册鲁教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年初中实验探究报告册九年级化学全一册鲁教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
2. 查询了解 $\mathrm{pH}$ 计测定溶液酸度的原理,了解如何使用 $\mathrm{pH}$ 计。
答案:
答题:
1. pH计测定溶液酸度的原理:pH计通过测量溶液中的氢离子活度来确定溶液的pH值。其主体是精密的玻璃电极和参比电极,玻璃电极对H⁺离子敏感,参比电极提供稳定的电位参考。当电极浸入溶液时,电池电动势与溶液的pH值成线性关系,通过校准和计算可得出溶液的pH值。
2. pH计的使用方法:
使用前需用标准缓冲溶液校准pH计。
将电极插入待测溶液,待读数稳定后记录pH值。
使用后清洗电极并妥善保存。
1. pH计测定溶液酸度的原理:pH计通过测量溶液中的氢离子活度来确定溶液的pH值。其主体是精密的玻璃电极和参比电极,玻璃电极对H⁺离子敏感,参比电极提供稳定的电位参考。当电极浸入溶液时,电池电动势与溶液的pH值成线性关系,通过校准和计算可得出溶液的pH值。
2. pH计的使用方法:
使用前需用标准缓冲溶液校准pH计。
将电极插入待测溶液,待读数稳定后记录pH值。
使用后清洗电极并妥善保存。
3. 有兴趣的同学可以查询,$\mathrm{pH}$ 与 $\mathrm{H}^+$ 浓度有什么关系?随 $\mathrm{H}^+$ 浓度的增大或减小,$\mathrm{pH}$ 有什么变化?
答案:
①$\mathrm{pH}$的定义为$\mathrm{pH}=-\lg c(\mathrm{H^+})$,其中$c(\mathrm{H^+})$为氢离子浓度,单位为$\mathrm{mol/L}$。
②当$c(\mathrm{H^+})$增大时,$\lg c(\mathrm{H^+})$的值增大,由于$\mathrm{pH}=-\lg c(\mathrm{H^+})$,所以$\mathrm{pH}$减小;当$c(\mathrm{H^+})$减小时,$\lg c(\mathrm{H^+})$的值减小,$\mathrm{pH}$增大。
②当$c(\mathrm{H^+})$增大时,$\lg c(\mathrm{H^+})$的值增大,由于$\mathrm{pH}=-\lg c(\mathrm{H^+})$,所以$\mathrm{pH}$减小;当$c(\mathrm{H^+})$减小时,$\lg c(\mathrm{H^+})$的值减小,$\mathrm{pH}$增大。
活动探究 2-7 酸和碱能否发生化学反应
探究起跑线
探究目的
1. 通过启发与交流,设计实验方案,经历“探究盐酸与氢氧化钠能否发生化学反应”的实验过程,增进对科学探究的理解,发展科学探究能力。
2. 初步学会借助 pH 的变化判断物质间是否发生化学反应的方法。
3. 提高设计实验方案的能力,初步形成“大胆猜想、小心求证”的科学态度。
探究准备
实验用品:溶质质量分数为 0.4%的盐酸、溶质质量分数为 0.4%的氢氧化钠溶液、蒸馏水;试管、胶头滴管、pH 试纸等。
探究主干线
问题情境
向盛有约 2 mL 0.4%的氢氧化钠溶液的试管中,用滴管滴加 0.4%的盐酸,观察现象。
提出问题
盐酸与氢氧化钠溶液发生化学反应了吗?
作出猜想
从微观角度推测,如果氢氧化钠溶液与盐酸没有发生化学反应,则 $OH^-$
收集证据
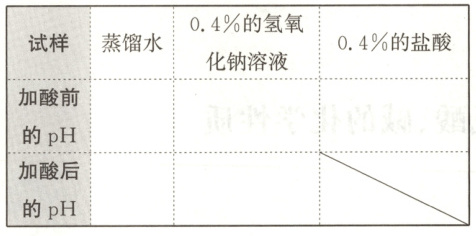
1. 用 pH 试纸分别测定蒸馏水、0.4%的氢氧化钠溶液和 0.4%的盐酸的 pH,将测定结果记录在表格中。
2. 分别量取 2 mL 蒸馏水和 2 mL 0.4%的氢氧化钠溶液于 2 支试管中,然后分别加入 2 mL 0.4%的盐酸,充分振荡后,测定所得溶液的 pH,将测定结果记录在表格中。
解释与结论
1. 通过上述实验记录可知:向 2 mL 0.4%的氢氧化钠溶液中加入 2 mL 0.4%盐酸后,溶液的 pH 由
2. 根据实验分析,pH 的明显变化是否是由溶液的稀释引起的?
3. 向盛有约 2 mL 0.4%的氢氧化钠溶液的试管中,用滴管逐滴滴加 0.4%的盐酸,虽然无明显现象发生,但实质上溶液中的 $OH^-$ 逐渐
探究反思
1. 结合教科书中有关内容分析:从酸、碱的本质看,盐酸与氢氧化钠发生中和反应,实质上是
2. 本实验我们通过测定
除此之外,我们还可以利用
前者从
3. 根据酸和碱的通性,除了利用以上两种方法外,我们还可以利用什么方法判断盐酸和氢氧化钠发生了化学反应?
探究起跑线
探究目的
1. 通过启发与交流,设计实验方案,经历“探究盐酸与氢氧化钠能否发生化学反应”的实验过程,增进对科学探究的理解,发展科学探究能力。
2. 初步学会借助 pH 的变化判断物质间是否发生化学反应的方法。
3. 提高设计实验方案的能力,初步形成“大胆猜想、小心求证”的科学态度。
探究准备
实验用品:溶质质量分数为 0.4%的盐酸、溶质质量分数为 0.4%的氢氧化钠溶液、蒸馏水;试管、胶头滴管、pH 试纸等。
探究主干线
问题情境
向盛有约 2 mL 0.4%的氢氧化钠溶液的试管中,用滴管滴加 0.4%的盐酸,观察现象。
提出问题
盐酸与氢氧化钠溶液发生化学反应了吗?
作出猜想
从微观角度推测,如果氢氧化钠溶液与盐酸没有发生化学反应,则 $OH^-$
不变
,pH不变
;如果氢氧化钠溶液与盐酸发生了化学反应,则 $OH^-$减少
,pH减小
。收集证据
1. 用 pH 试纸分别测定蒸馏水、0.4%的氢氧化钠溶液和 0.4%的盐酸的 pH,将测定结果记录在表格中。
2. 分别量取 2 mL 蒸馏水和 2 mL 0.4%的氢氧化钠溶液于 2 支试管中,然后分别加入 2 mL 0.4%的盐酸,充分振荡后,测定所得溶液的 pH,将测定结果记录在表格中。

解释与结论
1. 通过上述实验记录可知:向 2 mL 0.4%的氢氧化钠溶液中加入 2 mL 0.4%盐酸后,溶液的 pH 由
12
变为7
,溶液的 pH 发生了明显的变化。2. 根据实验分析,pH 的明显变化是否是由溶液的稀释引起的?
否
。因而 pH 发生的明显变化应从 $OH^-$ 的变化去考察。pH减小
(填“增大”或“减小”),$OH^-$减少
(填“增多”或“减少”),是溶液中的氢氧根离子($OH^-$)和氢离子($H^+$)结合成了水分子($H_2O$),导致溶液原有的酸碱性相互“中和”的结果。3. 向盛有约 2 mL 0.4%的氢氧化钠溶液的试管中,用滴管逐滴滴加 0.4%的盐酸,虽然无明显现象发生,但实质上溶液中的 $OH^-$ 逐渐
减少
,pH 逐渐减小
,生成了氯化钠
和水
,因而二者发生了中和反应。氢氧化钠与盐酸反应的化学方程式是NaOH + HCl = NaCl + H₂O
。探究反思
1. 结合教科书中有关内容分析:从酸、碱的本质看,盐酸与氢氧化钠发生中和反应,实质上是
H⁺
和OH⁻
结合生成了H₂O
。Na⁺
和Cl⁻
没有消耗,而是留在了溶液中。如果两种溶液恰好完全中和,最终得到的是氯化钠
溶液。2. 本实验我们通过测定
pH
的变化,来判断盐酸和氢氧化钠是否发生了化学反应。除此之外,我们还可以利用
酸碱指示剂(或酚酞试液)
来直观判断二者是否发生了化学反应。前者从
定量
的角度来判断,后者从定性的角度来判断。3. 根据酸和碱的通性,除了利用以上两种方法外,我们还可以利用什么方法判断盐酸和氢氧化钠发生了化学反应?
答案:
作出猜想:不变;不变;减少;减小 收集证据表格: | 试样 | 蒸馏水 | 0.4%的氢氧化钠溶液 | 0.4%的盐酸 | |--------------------|--------|---------------------|-------------| | 加酸前的pH | 7 | 12 | 2 | | 加酸后的pH | 3 | 7 | 2 | 解释与结论: 1. 12;7 2. 否;减小;减少 3. 减少;减小;氯化钠;水;NaOH + HCl = NaCl + H₂O
@@探究反思: 1. H⁺;OH⁻;H₂O;Na⁺;Cl⁻;氯化钠 2. pH;酸碱指示剂(或酚酞试液);定量 3. 测定反应前后溶液温度的变化(或加入碳酸钠观察是否产生气泡等)
@@探究反思: 1. H⁺;OH⁻;H₂O;Na⁺;Cl⁻;氯化钠 2. pH;酸碱指示剂(或酚酞试液);定量 3. 测定反应前后溶液温度的变化(或加入碳酸钠观察是否产生气泡等)
查看更多完整答案,请扫码查看


