2025年同步练习册人民教育出版社高中化学选择性必修第一册人教版A山东专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年同步练习册人民教育出版社高中化学选择性必修第一册人教版A山东专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
18. (12 分)以下是$20^{\circ}C$时几种难溶电解质的溶解度:
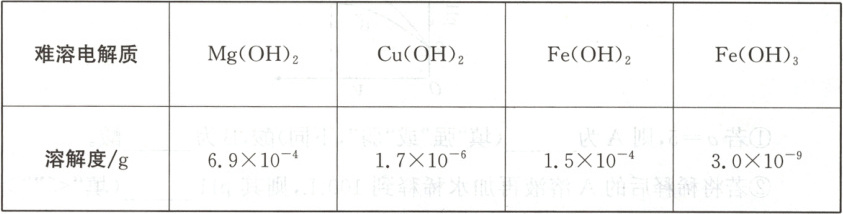
在无机化合物的提纯中,常利用难溶电解质的沉淀溶解平衡原理除去某些离子。
例如:
①为了除去氯化铵中的杂质$Fe^{3+}$,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质$Fe^{3+}$,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质$Fe^{2+}$,先将混合物溶于水,加入一定量的$H_{2}O_{2}$溶液,将$Fe^{2+}$氧化成$Fe^{3+}$,调节溶液的$pH = 4$,过滤结晶即可。
请回答下列问题。
(1)上述三个除杂方案都能够达到很好效果,$Fe^{2+}$、$Fe^{3+}$都被转化为
(2)①中加入的试剂应选择
(3)②中除去$Fe^{3+}$所发生的总反应的离子方程式为
(4)下列关于方案③相关的叙述中,正确的是
A. $H_{2}O_{2}$是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B. 将$Fe^{2+}$氧化为$Fe^{3+}$的主要原因是$Fe(OH)_{2}$沉淀比$Fe(OH)_{3}$沉淀较难过滤
C. 调节溶液$pH = 4$可选择的试剂是氢氧化铜或碱式碳酸铜等
D. $Cu^{2+}$可以大量存在于$pH = 4$的溶液中
E. 在$pH > 4$的溶液中,$Fe^{3+}$一定不能大量存在

在无机化合物的提纯中,常利用难溶电解质的沉淀溶解平衡原理除去某些离子。
例如:
①为了除去氯化铵中的杂质$Fe^{3+}$,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质$Fe^{3+}$,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质$Fe^{2+}$,先将混合物溶于水,加入一定量的$H_{2}O_{2}$溶液,将$Fe^{2+}$氧化成$Fe^{3+}$,调节溶液的$pH = 4$,过滤结晶即可。
请回答下列问题。
(1)上述三个除杂方案都能够达到很好效果,$Fe^{2+}$、$Fe^{3+}$都被转化为
$Fe(OH)_3$
(填化学式)而除去。(2)①中加入的试剂应选择
氨水
为宜,其原因是不会引入新的杂质
。(3)②中除去$Fe^{3+}$所发生的总反应的离子方程式为
$2Fe^{3+}(aq)+3Mg(OH)_2(s)\longrightarrow3Mg^{2+}(aq)+2Fe(OH)_3(s)$
。(4)下列关于方案③相关的叙述中,正确的是
ACDE
。A. $H_{2}O_{2}$是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B. 将$Fe^{2+}$氧化为$Fe^{3+}$的主要原因是$Fe(OH)_{2}$沉淀比$Fe(OH)_{3}$沉淀较难过滤
C. 调节溶液$pH = 4$可选择的试剂是氢氧化铜或碱式碳酸铜等
D. $Cu^{2+}$可以大量存在于$pH = 4$的溶液中
E. 在$pH > 4$的溶液中,$Fe^{3+}$一定不能大量存在
答案:
18.答案
(1)$Fe(OH)_3$
(2)氨水不会引入新的杂质
(3)$2Fe^{3+}(aq)+3Mg(OH)_2(s)\longrightarrow3Mg^{2+}(aq)+2Fe(OH)_3(s)$
(4)ACDE
解析①中为了不引入杂质离子,应加入氨水使$Fe^{3+}$沉淀,而不能用$NaOH$溶液等。②中根据数据可知$Mg(OH)_2$易转化为$Fe(OH)_3$,因此在$MgCl_2$溶液中加入足量$Mg(OH)_2$固体除去$Fe^{3+}$,然后将沉淀一并过滤。③中利用$Fe^{3+}$易水解的特点,据题意可知调节溶液的$pH=4$可使$Fe^{3+}$沉淀完全,为了不引入杂质离子,可使用$CuO$、$Cu(OH)_2$、$Cu_2(OH)_2CO_3$等。
(1)$Fe(OH)_3$
(2)氨水不会引入新的杂质
(3)$2Fe^{3+}(aq)+3Mg(OH)_2(s)\longrightarrow3Mg^{2+}(aq)+2Fe(OH)_3(s)$
(4)ACDE
解析①中为了不引入杂质离子,应加入氨水使$Fe^{3+}$沉淀,而不能用$NaOH$溶液等。②中根据数据可知$Mg(OH)_2$易转化为$Fe(OH)_3$,因此在$MgCl_2$溶液中加入足量$Mg(OH)_2$固体除去$Fe^{3+}$,然后将沉淀一并过滤。③中利用$Fe^{3+}$易水解的特点,据题意可知调节溶液的$pH=4$可使$Fe^{3+}$沉淀完全,为了不引入杂质离子,可使用$CuO$、$Cu(OH)_2$、$Cu_2(OH)_2CO_3$等。
19. (14 分)(1)$pH = 2$的$A$、$B$两种酸溶液各$1mL$,分别加水稀释到$1000mL$,其$pH$与溶液体积的关系如图所示。回答下列问题。
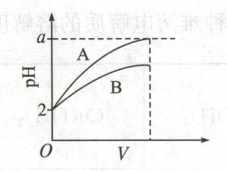
①若$a = 5$,则$A$为
②若将稀释后的$A$溶液再加水稀释到$100L$,则其$pH$
③若$A$、$B$都是弱酸,则$a$的范围是
(2)$25^{\circ}C$时,一元酸$HA$的电离常数$K_{a} = 1×10^{-8}$。
①$1mol·L^{-1}HA$溶液中,$c(H^{+}) =$
②$NaA$溶液中$A^{-}$的水解常数$K_{h} =$
③相同浓度的$HA$溶液与$NaA$溶液等体积混合后,溶液显

①若$a = 5$,则$A$为
强
(填“强”或“弱”,下同)酸,$B$为弱
酸。②若将稀释后的$A$溶液再加水稀释到$100L$,则其$pH$
$<$
(填“$<$”“$>$”或“$=$”)$7$。③若$A$、$B$都是弱酸,则$a$的范围是
$2<a<5$
。(2)$25^{\circ}C$时,一元酸$HA$的电离常数$K_{a} = 1×10^{-8}$。
①$1mol·L^{-1}HA$溶液中,$c(H^{+}) =$
$1×10^{-4}$
$mol·L^{-1}$。②$NaA$溶液中$A^{-}$的水解常数$K_{h} =$
$1×10^{-6}$
。③相同浓度的$HA$溶液与$NaA$溶液等体积混合后,溶液显
碱
(填“酸”“碱”或“中”)性。
答案:
19.答案
(1)①强弱②$<$③$2<a<5$
(2)①$1×10^{-4}$②$1×10^{-6}$③碱
解析
(1)①由$1\ mL$稀释到$1000\ mL$,强酸的$pH$变化$3$个单位,稀释时,弱酸电离程度增大,其$pH$变化应小于$3$个单位,所以A为强酸,B为弱酸。②酸稀释后仍显酸性,故$pH<7$。③若A、B都是弱酸,稀释后其$pH$应小于$5$,故$2<a<5$。
(2)①$HA$为弱酸,$HA$的电离平衡常数$K_a=1×10^{-8}$,$c(H^+)=\sqrt{K_a· c(HA)}\approx1×10^{-4}\ mol·L^{-1}$。
②$A^-$的水解方程式为$A^-+H_2O\rightleftharpoonsHA+OH^-$,其水解常数$K_h=\frac{K_w}{K_a}=\frac{1×10^{-14}}{1×10^{-8}}=1×10^{-6}$。③$A^-$的水解常数$K_h$大于$HA$的电离常数$K_a$,故相同浓度的$HA$溶液与$NaA$溶液等体积混合,溶液呈碱性。
(1)①强弱②$<$③$2<a<5$
(2)①$1×10^{-4}$②$1×10^{-6}$③碱
解析
(1)①由$1\ mL$稀释到$1000\ mL$,强酸的$pH$变化$3$个单位,稀释时,弱酸电离程度增大,其$pH$变化应小于$3$个单位,所以A为强酸,B为弱酸。②酸稀释后仍显酸性,故$pH<7$。③若A、B都是弱酸,稀释后其$pH$应小于$5$,故$2<a<5$。
(2)①$HA$为弱酸,$HA$的电离平衡常数$K_a=1×10^{-8}$,$c(H^+)=\sqrt{K_a· c(HA)}\approx1×10^{-4}\ mol·L^{-1}$。
②$A^-$的水解方程式为$A^-+H_2O\rightleftharpoonsHA+OH^-$,其水解常数$K_h=\frac{K_w}{K_a}=\frac{1×10^{-14}}{1×10^{-8}}=1×10^{-6}$。③$A^-$的水解常数$K_h$大于$HA$的电离常数$K_a$,故相同浓度的$HA$溶液与$NaA$溶液等体积混合,溶液呈碱性。
查看更多完整答案,请扫码查看


