2025年同步练习册人民教育出版社高中化学选择性必修第一册人教版A山东专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年同步练习册人民教育出版社高中化学选择性必修第一册人教版A山东专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
12. 将固体 $ NH_4Br $ 置于密闭容器中,在某温度下发生反应:$ NH_4Br(s) \rightleftharpoons NH_3(g) + HBr(g) $,$ 2HBr(g) \rightleftharpoons Br_2(g) + H_2(g) $,2 min 后,测得 $ H_2 $ 的浓度为 $ 0.5 \, mol · L^{-1} $,HBr 的浓度为 $ 4 \, mol · L^{-1} $,若上述反应速率用 $ v(NH_3) $ 表示,则下列速率正确的是(
A.$ 0.5 \, mol · L^{-1} · min^{-1} $
B.$ 2.5 \, mol · L^{-1} · min^{-1} $
C.$ 2 \, mol · L^{-1} · min^{-1} $
D.$ 1.25 \, mol · L^{-1} · min^{-1} $
B
)。A.$ 0.5 \, mol · L^{-1} · min^{-1} $
B.$ 2.5 \, mol · L^{-1} · min^{-1} $
C.$ 2 \, mol · L^{-1} · min^{-1} $
D.$ 1.25 \, mol · L^{-1} · min^{-1} $
答案:
12.B 解析$NH_4Br(s)$分解生成的HBr又有一部分分解,剩余HBr的量为$NH_4Br$分解生成的HBr与分解的HBr的差。由$c(H_2) = 0.5 mol · L^{-1}$知分解的$c(HBr) = 1 mol · L^{-1}$,所以$NH_4Br$分解生成的$c(HBr) = 4 mol · L^{-1} + 1 mol · L^{-1} = 5 mol · L^{-1}$,$c(NH_3) = 5 mol · L^{-1}$,$v(NH_3) = \frac{5 mol · L^{-1}}{2 min} = 2.5 mol · L^{-1} · min^{-1}$。
13. 为比较 $ Fe^{3+} $ 和 $ Cu^{2+} $ 对 $ H_2O_2 $ 分解反应的催化效果,甲、乙两同学分别设计了如图 1、图 2 所示的实验。下列叙述中不正确的是(
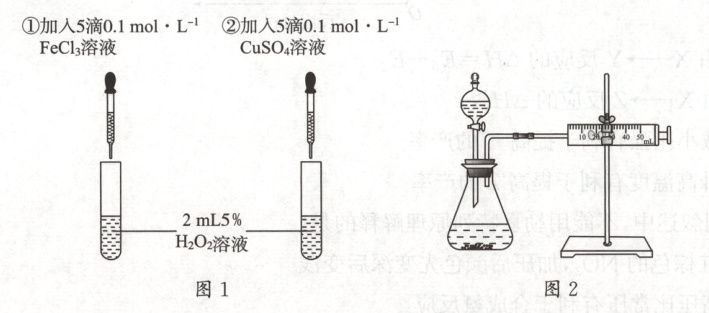
A.图 1 实验可通过定性观察产生气泡的快慢来比较反应速率的大小
B.若图 1 所示实验中反应速率为①>②,则一定说明 $ Fe^{3+} $ 比 $ Cu^{2+} $ 对 $ H_2O_2 $ 分解催化效果好
C.用图 2 装置比较反应速率,可测定在相同状况下反应产生的气体体积及反应时间
D.为检查图 2 装置的气密性,可关闭分液漏斗的活塞,将注射器活塞拉出一定距离到某处,一段时间后松开活塞,若活塞仍在某处,说明装置气密性良好
BD
)。
A.图 1 实验可通过定性观察产生气泡的快慢来比较反应速率的大小
B.若图 1 所示实验中反应速率为①>②,则一定说明 $ Fe^{3+} $ 比 $ Cu^{2+} $ 对 $ H_2O_2 $ 分解催化效果好
C.用图 2 装置比较反应速率,可测定在相同状况下反应产生的气体体积及反应时间
D.为检查图 2 装置的气密性,可关闭分液漏斗的活塞,将注射器活塞拉出一定距离到某处,一段时间后松开活塞,若活塞仍在某处,说明装置气密性良好
答案:
13.BD 解析 B项,若比较$Fe^{3+}$和$Cu^{2+}$对$H_2O_2$分解的催化作用,应选用阴离子相同的盐溶液,如$Fe_2(SO_4)_3$溶液和$CuSO_4$溶液。如果选用$FeCl_3$溶液和$CuSO_4$溶液,加入$FeCl_3$溶液产生气泡快,可能是$Cl^-$的催化作用。D项,检查图2装置的气密性,最后活塞回到原位置,说明装置气密性良好,若仍留在某处,说明装置漏气。
14. $ NaHSO_3 $ 溶液在不同温度下均可被过量 $ KIO_3 $ 氧化,当 $ NaHSO_3 $ 完全消耗即有 $ I_2 $ 析出,由 $ I_2 $ 析出所需时间可以求得 $ NaHSO_3 $ 的反应速率。将浓度均为 $ 0.020 \, mol · L^{-1} $ 的 $ NaHSO_3 $ 溶液(含少量淀粉)10.0 mL、$ KIO_3 $(过量)酸性溶液 40.0 mL 混合,记录 $ 10 \sim 55^{\circ}C $ 间溶液变蓝时间,$ 55^{\circ}C $ 时未观察到溶液变蓝,实验结果如下图。据图分析,下列判断不正确的是(
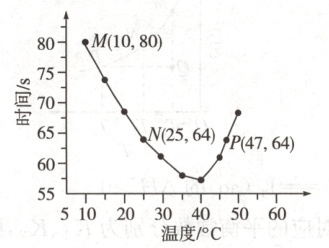
A.$ 40^{\circ}C $ 之前与 $ 40^{\circ}C $ 之后溶液变蓝的时间随温度的变化趋势相反
B.图中 N、P 两点对应的 $ NaHSO_3 $ 反应速率相等
C.图中 M 点对应的 $ NaHSO_3 $ 反应速率为 $ 5.0 × 10^{-5} \, mol · L^{-1} · s^{-1} $
D.$ 55^{\circ}C $ 时未观察到溶液变蓝,说明 $ NaHSO_3 $ 没有完全消耗
BD
)。
A.$ 40^{\circ}C $ 之前与 $ 40^{\circ}C $ 之后溶液变蓝的时间随温度的变化趋势相反
B.图中 N、P 两点对应的 $ NaHSO_3 $ 反应速率相等
C.图中 M 点对应的 $ NaHSO_3 $ 反应速率为 $ 5.0 × 10^{-5} \, mol · L^{-1} · s^{-1} $
D.$ 55^{\circ}C $ 时未观察到溶液变蓝,说明 $ NaHSO_3 $ 没有完全消耗
答案:
14.BD 解析 从图像中可以看出,40℃以前,温度越高,变蓝时间越短,40℃后温度越高,变蓝时间越长,A项正确;N、P点对应的反应温度不同,故速率不相等,B项错误;M点对应的$NaHSO_3$反应速率为$\frac{0.020 mol · L^{-1} × 10.0 mL}{ \frac{50 mL}{80 s}} = 5.0 × 10^{-5} mol · L^{-1} · s^{-1}$,C项正确;55℃时,没有出现蓝色,是因为温度过高,单质碘与淀粉没有形成稳定的蓝色物质,D项错误。
查看更多完整答案,请扫码查看


