2025年同步练习册人民教育出版社高中化学选择性必修第一册人教版A山东专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年同步练习册人民教育出版社高中化学选择性必修第一册人教版A山东专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
13. 一定温度下,在恒容密闭容器中发生如下反应:$2A(g)+B(g)\longrightarrow3C(g)+D(g)$,若反应开始时充入$2\ mol\ A$和$1\ mol\ B$,达到平衡时$C$的浓度为$a\ mol·L^{-1}$。维持容器容积和温度不变,按下列四种配比作为起始物质,达到平衡后,$C$的浓度仍为$a\ mol·L^{-1}$的是(
A.$4\ mol\ A+2\ mol\ B$
B.$2\ mol\ A+1\ mol\ B+3\ mol\ C+1\ mol\ D$
C.$3\ mol\ C+1\ mol\ D$
D.$1\ mol\ A+0.5\ mol\ B+1.5\ mol\ C+0.5\ mol\ D$
CD
)。A.$4\ mol\ A+2\ mol\ B$
B.$2\ mol\ A+1\ mol\ B+3\ mol\ C+1\ mol\ D$
C.$3\ mol\ C+1\ mol\ D$
D.$1\ mol\ A+0.5\ mol\ B+1.5\ mol\ C+0.5\ mol\ D$
答案:
13.CD 解析对于一般可逆反应,在恒温恒容条件下,只改变物质起始加入的量,若通过化学方程式都转化为反应物(或生成物),其物质的量与原平衡相同,则可达成完全相同的化学平衡状态。选项C和D中的投料,都转化为反应物,都是$2\ mol\ A$和$1\ mol\ B$,所以按照选项C或D中投料,反应达平衡后,C的浓度仍为$a\ mol· L^{-1}$。
14. 已知下列热化学方程式:
①$CH_4(g)+2O_2(g)\longrightarrowCO_2(g)+2H_2O(l)$ $\Delta H=-890.3\ kJ·mol^{-1}$
②$2C_2H_6(g)+7O_2(g)\longrightarrow4CO_2(g)+6H_2O(l)$ $\Delta H=-3119.6\ kJ·mol^{-1}$
③$C_2H_4(g)+3O_2(g)\longrightarrow2CO_2(g)+2H_2O(l)$ $\Delta H=-1411.0\ kJ·mol^{-1}$
④$2C_2H_2(g)+5O_2(g)\longrightarrow4CO_2(g)+2H_2O(l)$ $\Delta H=-2599.2\ kJ·mol^{-1}$
⑤$C_3H_8(g)+5O_2(g)\longrightarrow3CO_2(g)+4H_2O(l)$ $\Delta H=-2219.9\ kJ·mol^{-1}$
现有由$2\ mol$上述五种烃中的两种组成的气体混合物,经充分燃烧后放出$3037\ kJ$热量,则下列组合中可能的是(
A.$C_2H_6$和$C_3H_8$
B.$C_2H_2$和$C_3H_8$
C.$C_2H_4$和$C_2H_6$
D.$CH_4$和$C_2H_4$
①$CH_4(g)+2O_2(g)\longrightarrowCO_2(g)+2H_2O(l)$ $\Delta H=-890.3\ kJ·mol^{-1}$
②$2C_2H_6(g)+7O_2(g)\longrightarrow4CO_2(g)+6H_2O(l)$ $\Delta H=-3119.6\ kJ·mol^{-1}$
③$C_2H_4(g)+3O_2(g)\longrightarrow2CO_2(g)+2H_2O(l)$ $\Delta H=-1411.0\ kJ·mol^{-1}$
④$2C_2H_2(g)+5O_2(g)\longrightarrow4CO_2(g)+2H_2O(l)$ $\Delta H=-2599.2\ kJ·mol^{-1}$
⑤$C_3H_8(g)+5O_2(g)\longrightarrow3CO_2(g)+4H_2O(l)$ $\Delta H=-2219.9\ kJ·mol^{-1}$
现有由$2\ mol$上述五种烃中的两种组成的气体混合物,经充分燃烧后放出$3037\ kJ$热量,则下列组合中可能的是(
BC
)。A.$C_2H_6$和$C_3H_8$
B.$C_2H_2$和$C_3H_8$
C.$C_2H_4$和$C_2H_6$
D.$CH_4$和$C_2H_4$
答案:
14.BC 解析题中所给五种气体$CH_4$、$C_2H_6$、$C_2H_4$、$C_2H_2$、$C_3H_8$的燃烧热分别为$890.3\ kJ· mol^{-1}$、$1559.8\ kJ· mol^{-1}$、$1411.0\ kJ· mol^{-1}$、$1299.6\ kJ· mol^{-1}$、$2219.9\ kJ· mol^{-1}$。$2\ mol$混合气体完全燃烧放出的热量为$3037\ kJ$,所以平均燃烧热为$1518.5\ kJ· mol^{-1}$,混合物中两种烃的燃烧热应该一个比$1518.5\ kJ· mol^{-1}$大,一个比$1518.5\ kJ· mol^{-1}$小。而$C_2H_6$和$C_3H_8$的燃烧热均大于$1518.5\ kJ· mol^{-1}$,$CH_4$和$C_2H_4$的燃烧热均小于$1518.5\ kJ· mol^{-1}$,所以选项A、D不可能。
15. 可逆反应①$X(g)+2Y(g)\longrightarrow2Z(g)$,②$2M(g)\longrightarrowN(g)+P(g)$分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关的变化如图所示:
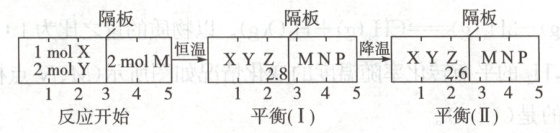
下列判断正确的是(
A.反应①的正反应是放热反应
B.达到平衡$(I)$时体系的压强与反应开始时体系的压强之比为$14:15$
C.达到平衡$(I)$时,$X$的转化率为$\frac{5}{11}$
D.在平衡$(I)$和平衡$(II)$中,$M$的体积分数相等

下列判断正确的是(
AC
)。A.反应①的正反应是放热反应
B.达到平衡$(I)$时体系的压强与反应开始时体系的压强之比为$14:15$
C.达到平衡$(I)$时,$X$的转化率为$\frac{5}{11}$
D.在平衡$(I)$和平衡$(II)$中,$M$的体积分数相等
答案:
15.AC 解析平衡(Ⅰ)降温后到平衡(Ⅱ)的过程中,$①$反应正向进行,因为左侧反应室内气体的物质的量进一步减小,所以反应$①$正向为放热反应,A项正确;达到平衡(Ⅰ)时反应引起气体物质的量减小,反应$②$气体的物质的量始终不变,因为隔板可滑动,所以左、右两个反应室内压强相等,对于反应$②$来说$\frac{p前}{p后}=\frac{V后}{V前}=\frac{2.2}{2}=\frac{11}{10}$,B项错误;达到平衡(Ⅰ)时,反应$②$中各物质的量之和为$2\ mol$,利用三段式,设转化的X的物质的量为$x\ mol$,则
$X(g)+2Y(g)\rightleftharpoons2Z(g)$
起始$/mol\ \ 1\ \ \ \ \ \ \ \ \ \ \ \ 2$
转化$/mol\ \ x\ \ \ \ \ \ \ \ \ \ \ 2x\ \ \ \ \ \ \ \ \ \ \ 2x$
平衡$/mol\ \ 1-x\ \ \ \ \ \ \ \ 2-2x\ \ \ \ \ \ \ \ \ 2x$
左、右两个反应室内气体压强相等,体积之比等于物质的量之比,$\frac{1-x+2-2x+2x}{2}=\frac{2.8}{2.2}$,可得$x=\frac{5}{11}$,C项正确;由于温度改变时,化学平衡一定发生移动,则降温后,平衡(Ⅱ)与平衡(Ⅰ)中M的体积分数一定不同,D项错误。
$X(g)+2Y(g)\rightleftharpoons2Z(g)$
起始$/mol\ \ 1\ \ \ \ \ \ \ \ \ \ \ \ 2$
转化$/mol\ \ x\ \ \ \ \ \ \ \ \ \ \ 2x\ \ \ \ \ \ \ \ \ \ \ 2x$
平衡$/mol\ \ 1-x\ \ \ \ \ \ \ \ 2-2x\ \ \ \ \ \ \ \ \ 2x$
左、右两个反应室内气体压强相等,体积之比等于物质的量之比,$\frac{1-x+2-2x+2x}{2}=\frac{2.8}{2.2}$,可得$x=\frac{5}{11}$,C项正确;由于温度改变时,化学平衡一定发生移动,则降温后,平衡(Ⅱ)与平衡(Ⅰ)中M的体积分数一定不同,D项错误。
查看更多完整答案,请扫码查看


