2025年同步练习册人民教育出版社高中化学选择性必修第一册人教版A山东专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年同步练习册人民教育出版社高中化学选择性必修第一册人教版A山东专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
1. 根据如图所示的反应判断下列说法中错误的是(
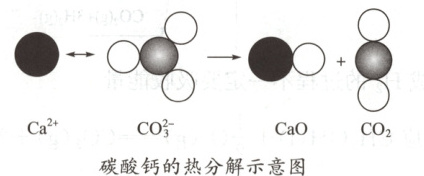
A.$1\ mol\ CO_{2}(g)$和$1\ mol\ CaO(s)$的总能量大于$1\ mol\ CaCO_{3}(s)$的总能量
B.该反应的$\Delta H>0$
C.该反应中有离子键断裂也有共价键断裂,化学键断裂吸收能量,化学键形成放出能量
D.由该反应可推出凡是需要加热才发生的反应均为吸热反应
D
)。
A.$1\ mol\ CO_{2}(g)$和$1\ mol\ CaO(s)$的总能量大于$1\ mol\ CaCO_{3}(s)$的总能量
B.该反应的$\Delta H>0$
C.该反应中有离子键断裂也有共价键断裂,化学键断裂吸收能量,化学键形成放出能量
D.由该反应可推出凡是需要加热才发生的反应均为吸热反应
答案:
1. D 解析 因为碳酸钙受热分解是吸热反应, 1 mol $\mathrm{CO_2(g)}$ 和 1 mol $\mathrm{CaO(s)}$ 的总能量大于 1 mol $\mathrm{CaCO_3(s)}$ 的总能量,$\Delta H>0$,故 A、B 项正确;在 $\mathrm{CaCO_3}$ 中,$\mathrm{Ca^{2+}}$ 和 $\mathrm{CO_3^{2-}}$ 之间存在离子键, $\mathrm{CO_3^{2-}}$ 中,C 与 O 之间存在共价键,故反应中有离子键断裂也有共价键断裂,断键吸收能量,成键放出能量,C 项正确;需要加热才发生的反应不一定为吸热反应,如碳单质的燃烧反应就是放热反应, D 项错误。
2. 符合如图所示的化学反应的热化学方程式是(
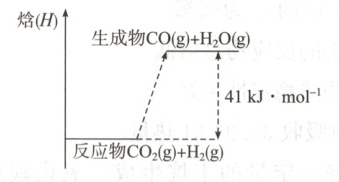
A.$CO + H_{2}O = CO_{2} + H_{2}\ \ \Delta H = +41\ kJ· mol^{-1}$
B.$CO_{2}(g) + H_{2}(g) = CO(g) + H_{2}O(g)\ \ \Delta H = +41\ kJ· mol^{-1}$
C.$CO(g) + H_{2}O(g) = CO_{2}(g) + H_{2}(g)\ \ \Delta H = -41\ kJ· mol^{-1}$
D.$CO_{2}(g) + H_{2}(g) = CO(g) + H_{2}O(g)\ \ \Delta H = -41\ kJ· mol^{-1}$
B
)。
A.$CO + H_{2}O = CO_{2} + H_{2}\ \ \Delta H = +41\ kJ· mol^{-1}$
B.$CO_{2}(g) + H_{2}(g) = CO(g) + H_{2}O(g)\ \ \Delta H = +41\ kJ· mol^{-1}$
C.$CO(g) + H_{2}O(g) = CO_{2}(g) + H_{2}(g)\ \ \Delta H = -41\ kJ· mol^{-1}$
D.$CO_{2}(g) + H_{2}(g) = CO(g) + H_{2}O(g)\ \ \Delta H = -41\ kJ· mol^{-1}$
答案:
2. B 解析 从题图可知,由 $\mathrm{CO_2(g)}$ 与 $\mathrm{H_2(g)}$ 反应生成 $\mathrm{CO(g)}$ 和 $\mathrm{H_2O(g)}$,该反应是吸热反应, $\Delta H=+41\ \mathrm{kJ· mol^{-1}}$,B 项正确。
3. 下列与化学反应能量变化相关的叙述正确的是(
A.生成物总焓一定小于反应物总焓
B.放热反应的化学反应速率总是大于吸热反应的化学反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,$H_{2}(g) + Cl_{2}(g) = 2HCl(g)$在光照和点燃条件下的$\Delta H$不同
C
)。A.生成物总焓一定小于反应物总焓
B.放热反应的化学反应速率总是大于吸热反应的化学反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,$H_{2}(g) + Cl_{2}(g) = 2HCl(g)$在光照和点燃条件下的$\Delta H$不同
答案:
3. C 解析 生成物总焓小于反应物总焓的反应是放热反应,A 项错误;化学反应速率由反应物本身的性质决定,受压强、温度、浓度、催化剂等因素影响,与反应放热或吸热无关,B 项错误;根据盖斯定律可知,反应的焓变与反应过程无关,只与反应始态和终态有关,同温同压下,同一反应的 $\Delta H$ 不因反应条件的改变而改变,D 项错误。
4. 下列说法中正确的是(
A.任何条件下的热效应都是焓变
B.书写热化学方程式时,若不标明温度和压强,则表示是在$0^{\circ}C$和$101\ kPa$条件下的反应热
C.化学反应中的能量变化,是由反应物分子中化学键断裂时吸收的能量与生成物分子中化学键形成时放出的能量不同所导致的
D.吸热反应的$\Delta H<0$,放热反应的$\Delta H>0$
C
)。A.任何条件下的热效应都是焓变
B.书写热化学方程式时,若不标明温度和压强,则表示是在$0^{\circ}C$和$101\ kPa$条件下的反应热
C.化学反应中的能量变化,是由反应物分子中化学键断裂时吸收的能量与生成物分子中化学键形成时放出的能量不同所导致的
D.吸热反应的$\Delta H<0$,放热反应的$\Delta H>0$
答案:
4. C 解析 焓变描述的是恒压条件下的热效应,A 项错误;书写热化学方程式时,若不标明温度和压强,则表示是在 $25\ °\mathrm{C}$ 和 $101\ \mathrm{kPa}$ 条件下的反应热,B 项错误;吸热反应的 $\Delta H>0$,放热反应的 $\Delta H<0$,D 项错误。
查看更多完整答案,请扫码查看


