2026年易点通基础提分化学山西专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年易点通基础提分化学山西专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第103页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
右图是甲、乙、丙三种物质的溶解度曲线图。请回答:
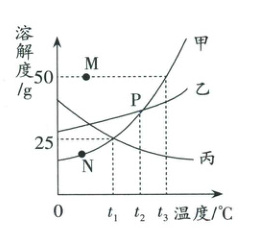
1. 比较同一温度下不同物质溶解度的大小。
例:$t_{3}\ ^{\circ}C$时甲、乙、丙三种物质的溶解度由大到小的顺序是
2. 曲线上的交点,表示在某一温度下两物质的溶解度相等。
例:P点表示的意义是
3. M、P、N三点相对于甲物质的曲线来讲,M点代表曲线上区域内的点,表示过饱和溶液,即溶液中还有未溶解的溶质;P点代表曲线中的点,表示饱和溶液;N点代表曲线下区域内的点,表示不饱和溶液。
4. 结晶方法的选择:
①降温结晶(冷却热饱和溶液):溶解度受温度变化影响较大的物质(从甲物质的饱和溶液中得到甲,如硝酸钾)。
②蒸发结晶:溶解度
③升温结晶:溶解度
5. 物质提纯方法的选择:想提纯什么物质,就看该物质适用于什么结晶方法。
①固体甲中含有少量的固体乙,提纯固体甲的方法:加水溶解、加热浓缩、
②固体乙中含有少量的固体甲,提纯固体乙的方法:加水溶解、
6. $t_{3}\ ^{\circ}C$时,等量的甲、乙、丙三种物质的饱和溶液中,
7. 升温或降温后比较三种溶液中溶质质量分数的大小:依据公式$\dfrac{S}{100\ g+S}×100\%$,即溶解度大的物质,对应饱和溶液的溶质质量分数就大。
①饱和溶液→饱和溶液时,根据末温时的溶解度计算溶质质量分数(溶解度发生变化,溶质的质量分数发生变化)。
②饱和溶液→不饱和溶液时,根据初温时的溶解度计算溶质质量分数(溶解度虽然发生变化,但溶液变为不饱和溶液,溶质的质量分数没有发生变化,所以按初温下的溶解度计算溶质的质量分数)。
例:现有$t_{3}\ ^{\circ}C$的甲、乙、丙三种物质的饱和溶液,降温到$t_{1}\ ^{\circ}C$,则溶液的溶质质量分数由大到小的顺序是
分析:从$t_{3}\ ^{\circ}C$降温到$t_{1}\ ^{\circ}C$时,甲、乙的饱和溶液仍为饱和溶液,则根据$t_{1}\ ^{\circ}C$时甲、乙物质的溶解度来计算溶质的质量分数,从图可以看出,$t_{1}\ ^{\circ}C$时乙物质的溶解度大于甲物质,所以乙溶液中溶质的质量分数大于甲,从$t_{3}\ ^{\circ}C$降温到$t_{1}\ ^{\circ}C$时,丙物质由饱和溶液变为不饱和溶液,其溶质质量分数不变,仍为$t_{3}\ ^{\circ}C$时其饱和溶液的溶质质量分数。
8. 通过曲线趋势,选择饱和溶液和不饱和溶液的相互转化措施(特别是升温或降温)。
例:$t_{1}\ ^{\circ}C$时要使接近饱和的甲溶液变成饱和溶液,可采用的方法有
9. 某温度下,定量的水中加入一定量的某物质,判断形成溶液的质量及是否饱和(核心是思考能否全溶)。
例:$t_{3}\ ^{\circ}C$时,将$30\ g$甲物质放入$50\ g$水中,充分溶解后所得溶液是
10. 判断物质的溶解性,依据是该物质在$20\ ^{\circ}C$(室温条件下)的溶解度($<0.01\ g$时为难溶;$0.01\sim1\ g$时为微溶;$1\sim10\ g$时为可溶;$>10\ g$时为易溶)。
例:若$t_{1}\ ^{\circ}C$为$20\ ^{\circ}C$时,丙物质的溶解性为

1. 比较同一温度下不同物质溶解度的大小。
例:$t_{3}\ ^{\circ}C$时甲、乙、丙三种物质的溶解度由大到小的顺序是
甲>乙>丙
。2. 曲线上的交点,表示在某一温度下两物质的溶解度相等。
例:P点表示的意义是
t₂℃时甲乙两种物质的溶解度相等
。3. M、P、N三点相对于甲物质的曲线来讲,M点代表曲线上区域内的点,表示过饱和溶液,即溶液中还有未溶解的溶质;P点代表曲线中的点,表示饱和溶液;N点代表曲线下区域内的点,表示不饱和溶液。
4. 结晶方法的选择:
①降温结晶(冷却热饱和溶液):溶解度受温度变化影响较大的物质(从甲物质的饱和溶液中得到甲,如硝酸钾)。
②蒸发结晶:溶解度
受温度变化影响不大的
物质(从乙物质的饱和溶液中得到乙,如氯化钠
)。③升温结晶:溶解度
随温度的升高而减小的
物质(从丙物质的饱和溶液中得到丙,如氢氧化钙
)。5. 物质提纯方法的选择:想提纯什么物质,就看该物质适用于什么结晶方法。
①固体甲中含有少量的固体乙,提纯固体甲的方法:加水溶解、加热浓缩、
降温结晶
、过滤、洗涤(冷水)、干燥;②固体乙中含有少量的固体甲,提纯固体乙的方法:加水溶解、
蒸发结晶
、过滤、洗涤(热水)、干燥。6. $t_{3}\ ^{\circ}C$时,等量的甲、乙、丙三种物质的饱和溶液中,
甲
中所含水的量最少(或者说在$t_{3}\ ^{\circ}C$时将等质量的甲、乙、丙三种物质配成饱和溶液,甲
物质需要的水最少),因为在$t_{3}\ ^{\circ}C$时等量的水中甲物质溶解的最多,即等质量的饱和溶液中,溶解度大的物质所含的水少。7. 升温或降温后比较三种溶液中溶质质量分数的大小:依据公式$\dfrac{S}{100\ g+S}×100\%$,即溶解度大的物质,对应饱和溶液的溶质质量分数就大。
①饱和溶液→饱和溶液时,根据末温时的溶解度计算溶质质量分数(溶解度发生变化,溶质的质量分数发生变化)。
②饱和溶液→不饱和溶液时,根据初温时的溶解度计算溶质质量分数(溶解度虽然发生变化,但溶液变为不饱和溶液,溶质的质量分数没有发生变化,所以按初温下的溶解度计算溶质的质量分数)。
例:现有$t_{3}\ ^{\circ}C$的甲、乙、丙三种物质的饱和溶液,降温到$t_{1}\ ^{\circ}C$,则溶液的溶质质量分数由大到小的顺序是
乙>甲>丙
。分析:从$t_{3}\ ^{\circ}C$降温到$t_{1}\ ^{\circ}C$时,甲、乙的饱和溶液仍为饱和溶液,则根据$t_{1}\ ^{\circ}C$时甲、乙物质的溶解度来计算溶质的质量分数,从图可以看出,$t_{1}\ ^{\circ}C$时乙物质的溶解度大于甲物质,所以乙溶液中溶质的质量分数大于甲,从$t_{3}\ ^{\circ}C$降温到$t_{1}\ ^{\circ}C$时,丙物质由饱和溶液变为不饱和溶液,其溶质质量分数不变,仍为$t_{3}\ ^{\circ}C$时其饱和溶液的溶质质量分数。
8. 通过曲线趋势,选择饱和溶液和不饱和溶液的相互转化措施(特别是升温或降温)。
例:$t_{1}\ ^{\circ}C$时要使接近饱和的甲溶液变成饱和溶液,可采用的方法有
增加溶质(或蒸发溶剂)
(写出一种)。9. 某温度下,定量的水中加入一定量的某物质,判断形成溶液的质量及是否饱和(核心是思考能否全溶)。
例:$t_{3}\ ^{\circ}C$时,将$30\ g$甲物质放入$50\ g$水中,充分溶解后所得溶液是
饱和
(填“饱和”或“不饱和”)溶液,其质量是75
$g$。10. 判断物质的溶解性,依据是该物质在$20\ ^{\circ}C$(室温条件下)的溶解度($<0.01\ g$时为难溶;$0.01\sim1\ g$时为微溶;$1\sim10\ g$时为可溶;$>10\ g$时为易溶)。
例:若$t_{1}\ ^{\circ}C$为$20\ ^{\circ}C$时,丙物质的溶解性为
易溶
。
答案:
1.甲>乙>丙
2.t₂℃时甲乙两种物质的溶解度相等
4.②受温度变化影响不大的 氯化钠③随温度的升高而减小的 氢氧化钙
5.①降温结晶 ②蒸发结晶
6.甲 甲
7.乙>甲>丙
8.增加溶质(或蒸发溶剂)
9.饱和 75
10.易溶
2.t₂℃时甲乙两种物质的溶解度相等
4.②受温度变化影响不大的 氯化钠③随温度的升高而减小的 氢氧化钙
5.①降温结晶 ②蒸发结晶
6.甲 甲
7.乙>甲>丙
8.增加溶质(或蒸发溶剂)
9.饱和 75
10.易溶
查看更多完整答案,请扫码查看


