第63页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
6. 近年来,温室气体过量排放导致的气候异常,已经成为人类社会最大的生态难题。二氧化碳的捕集、利用与封存技术是应对全球气候变化的关键技术之一。请完成各题。
(1)日常生活、生产中排放的过量$CO_2$主要来自
(2)捕集$CO_2$的方法主要有:吸收法、膜分离法等。用吸收法从燃烧产生的烟气中捕集$CO_2$时,可以使用足量的氢氧化钙溶液,该反应的化学方程式为
$(3)CO_2$的封存方式包括地质封存与海洋封存,用海洋封存$CO_2$时,一部分$CO_2$被海水吸收,有关反应的化学方程式为
$(4)CO_2$的转化利用是近年来科学家们研究的热点。如用光催化水氧化法将$CO_2$转化为甲烷,除此以外,以$CO_2$和其他物质为原料,还可以生产

(1)日常生活、生产中排放的过量$CO_2$主要来自
化石能源的燃烧
。空气中$CO_2$过量导致的气候异常现象是温室效应加剧(合理即可)
。(2)捕集$CO_2$的方法主要有:吸收法、膜分离法等。用吸收法从燃烧产生的烟气中捕集$CO_2$时,可以使用足量的氢氧化钙溶液,该反应的化学方程式为
Ca(OH)₂ + CO₂ = CaCO₃↓ + H₂O
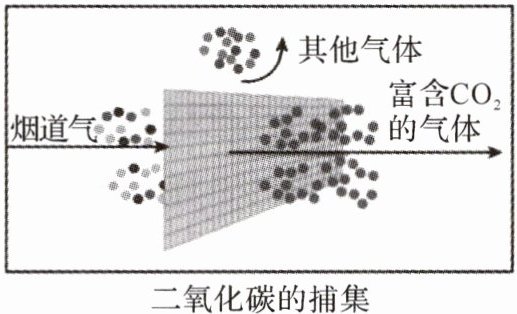
。用膜分离法捕集$CO_2($如图所示)的过程中,发生的变化属于物理变化
。$(3)CO_2$的封存方式包括地质封存与海洋封存,用海洋封存$CO_2$时,一部分$CO_2$被海水吸收,有关反应的化学方程式为
CO₂ + H₂O = H₂CO₃
。$(4)CO_2$的转化利用是近年来科学家们研究的热点。如用光催化水氧化法将$CO_2$转化为甲烷,除此以外,以$CO_2$和其他物质为原料,还可以生产
碳酸饮料(合理即可)
。
答案:
(1)化石能源的燃烧 温室效应加剧(合理即可)
(2)Ca(OH)₂ + CO₂ = CaCO₃↓ + H₂O 物理变化 (⑶)CO₂ + H₂O = H₂CO₃
(4)碳酸饮料(合理即可)
(1)化石能源的燃烧 温室效应加剧(合理即可)
(2)Ca(OH)₂ + CO₂ = CaCO₃↓ + H₂O 物理变化 (⑶)CO₂ + H₂O = H₂CO₃
(4)碳酸饮料(合理即可)
7. 阅读下列短文,回答问题。
碳在自然界中的循环变化,对于生态环境有极为重要的意义。随着工业生产的高速发展和人们生活水平的提高,排入大气中的$CO_2$越来越多,导致温室效应增强。减少$CO_2$排放,实现碳中和,已成为全球共识。碳替代、碳减排、碳封存、碳循环是实现碳中和的主要途径。研究机构发明了转化大气中二氧化碳的技术,该技术是在一定条件下,二氧化碳和氢气反应生成甲醇$(CH_3OH)$和水。甲醇的产率除受浓度、温度、压强等因素影响外,还受催化剂CuO的质量分数影响(如图1)。“碳循环”(如图2)是指碳元素在地球上的生物圈、岩石圈、水圈及大气圈中交换,并随地球的运动循环不止的现象。
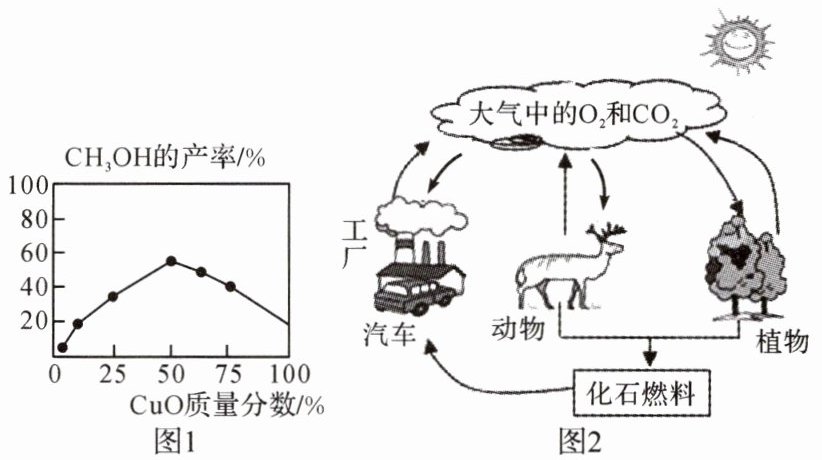
(1)图2是自然界中的碳循环和氧循环示意图。下列说法正确的是(
$A. CO_2$的产生途径主要有化石燃料的燃烧、动植物的呼吸作用和绿色植物的光合作用
$B. 碳循环和氧循环分别是指$CO_2$和$O_2$的循环$C. 碳循环和氧循环过程中均发生了化学反应
(2)写出$CO_2$和$H_2$在催化剂条件下生成$CH_3OH$和水的化学方程式:
(3)根据图1写出一条甲醇的产率与CuO质量分数的规律(或关系)
(4)请你谈一谈生活中实现“碳中和”的具体措施
碳在自然界中的循环变化,对于生态环境有极为重要的意义。随着工业生产的高速发展和人们生活水平的提高,排入大气中的$CO_2$越来越多,导致温室效应增强。减少$CO_2$排放,实现碳中和,已成为全球共识。碳替代、碳减排、碳封存、碳循环是实现碳中和的主要途径。研究机构发明了转化大气中二氧化碳的技术,该技术是在一定条件下,二氧化碳和氢气反应生成甲醇$(CH_3OH)$和水。甲醇的产率除受浓度、温度、压强等因素影响外,还受催化剂CuO的质量分数影响(如图1)。“碳循环”(如图2)是指碳元素在地球上的生物圈、岩石圈、水圈及大气圈中交换,并随地球的运动循环不止的现象。

(1)图2是自然界中的碳循环和氧循环示意图。下列说法正确的是(
C
)。$A. CO_2$的产生途径主要有化石燃料的燃烧、动植物的呼吸作用和绿色植物的光合作用
$B. 碳循环和氧循环分别是指$CO_2$和$O_2$的循环$C. 碳循环和氧循环过程中均发生了化学反应
(2)写出$CO_2$和$H_2$在催化剂条件下生成$CH_3OH$和水的化学方程式:
CO₂ + 3H₂ =催化剂CH₃OH + H₂O
。(3)根据图1写出一条甲醇的产率与CuO质量分数的规律(或关系)
在其他条件相同时,氧化铜的质量分数为 50%时,甲醇的产率最高
。(4)请你谈一谈生活中实现“碳中和”的具体措施
日常绿色出行,少乘坐私家车合理即可
。
答案:
(1)C
(2)CO₂ + 3H₂ =催化剂CH₃OH + H₂O
(3)在其他条件相同时,氧化铜的质量分数为 50%时,甲醇的产率最高 (⑷)日常绿色出行,少乘坐私家车合理即可)
(1)C
(2)CO₂ + 3H₂ =催化剂CH₃OH + H₂O
(3)在其他条件相同时,氧化铜的质量分数为 50%时,甲醇的产率最高 (⑷)日常绿色出行,少乘坐私家车合理即可)
查看更多完整答案,请扫码查看


