第20页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
1. 某考古团队在发掘被火山灰覆盖的绘画时,用激光设备打碎其表面附着的极小的石灰岩,这个过程会释放出钙离子,钙离子与火山灰周围的氟离子结合形成氟化钙($CaF_2$)。氟化钙在物质分类上属于 ( )
A.酸
B.碱
C.盐
D.氧化物
A.酸
B.碱
C.盐
D.氧化物
答案:
C
2. 下列各组物质中,全都不溶于水的一组是( )
A.$AgCl$、$BaCO_3$、$BaSO_4$
B.$CaCO_3$、$KNO_3$、$BaCl_2$
C.$CuSO_4$、$AgNO_3$、$Mg(OH)_2$
D.$Na_2CO_3$、$NaCl$、$NH_4NO_3$
A.$AgCl$、$BaCO_3$、$BaSO_4$
B.$CaCO_3$、$KNO_3$、$BaCl_2$
C.$CuSO_4$、$AgNO_3$、$Mg(OH)_2$
D.$Na_2CO_3$、$NaCl$、$NH_4NO_3$
答案:
A
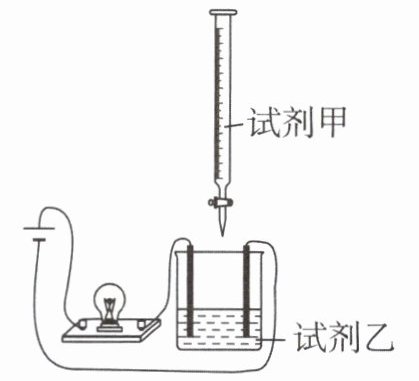
3. 使用如图所示装置(搅拌装置略)探究溶液离子浓度变化,已知反应的产物如果全部是沉淀(或沉淀和水)时灯光会变暗。下列灯光变化可能出现“亮→暗(或灭)→亮”现象的是 ( )
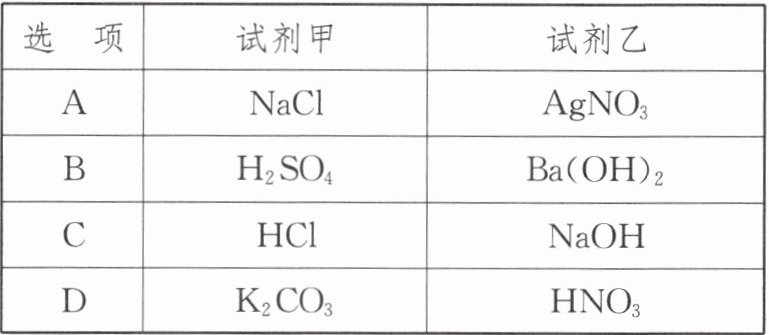
| 选项 | 试剂甲 | 试剂乙 |
| A | $NaCl$ | $AgNO_3$ |
| B | $H_2SO_4$ | $Ba(OH)_2$ |
| C | $HCl$ | $NaOH$ |
| D | $K_2CO_3$ | $HNO_3$ |
| 选项 | 试剂甲 | 试剂乙 |

| A | $NaCl$ | $AgNO_3$ |
| B | $H_2SO_4$ | $Ba(OH)_2$ |
| C | $HCl$ | $NaOH$ |
| D | $K_2CO_3$ | $HNO_3$ |

答案:
B
4. 有一包不纯的$K_2CO_3$样品,含有一定量的$KOH和KCl$。现需测定该样品中$K_2CO_3$的质量分数,取10 g样品充分溶解后进行实验。下列方案合理的是 ( )
A.加入过量的$Ca(OH)_2$固体,充分反应后过滤,称滤渣的质量
B.加入足量溶质质量分数为7.3%的稀盐酸,称反应后溶液的质量
C.加入足量的$MgCl_2$溶液,充分反应后过滤、洗涤,将滤渣干燥、称重
D.加入足量的$BaCl_2$溶液,充分反应后过滤、洗涤,将滤渣干燥、称重
A.加入过量的$Ca(OH)_2$固体,充分反应后过滤,称滤渣的质量
B.加入足量溶质质量分数为7.3%的稀盐酸,称反应后溶液的质量
C.加入足量的$MgCl_2$溶液,充分反应后过滤、洗涤,将滤渣干燥、称重
D.加入足量的$BaCl_2$溶液,充分反应后过滤、洗涤,将滤渣干燥、称重
答案:
解:分析各选项:
A. 加入过量Ca(OH)₂固体,Ca(OH)₂微溶于水,滤渣中会混有未溶解的Ca(OH)₂,导致滤渣质量偏大,无法准确测定,不合理。
B. 加入足量7.3%稀盐酸,K₂CO₃、KOH均与盐酸反应生成KCl、H₂O,K₂CO₃反应还生成CO₂气体。称反应后溶液质量,需计算CO₂质量,但样品中KOH与盐酸反应不产生气体,无法通过溶液质量差单独求出K₂CO₃的量,不合理。
C. 加入足量MgCl₂溶液,K₂CO₃与MgCl₂反应生成MgCO₃沉淀,KOH与MgCl₂反应生成Mg(OH)₂沉淀,两种沉淀同时存在,无法通过滤渣质量单独计算K₂CO₃的质量,不合理。
D. 加入足量BaCl₂溶液,只有K₂CO₃与BaCl₂反应生成BaCO₃沉淀(KOH、KCl与BaCl₂不反应)。过滤、洗涤、干燥后称BaCO₃质量,根据化学方程式可计算出K₂CO₃质量,进而求出质量分数,合理。
结论:D
A. 加入过量Ca(OH)₂固体,Ca(OH)₂微溶于水,滤渣中会混有未溶解的Ca(OH)₂,导致滤渣质量偏大,无法准确测定,不合理。
B. 加入足量7.3%稀盐酸,K₂CO₃、KOH均与盐酸反应生成KCl、H₂O,K₂CO₃反应还生成CO₂气体。称反应后溶液质量,需计算CO₂质量,但样品中KOH与盐酸反应不产生气体,无法通过溶液质量差单独求出K₂CO₃的量,不合理。
C. 加入足量MgCl₂溶液,K₂CO₃与MgCl₂反应生成MgCO₃沉淀,KOH与MgCl₂反应生成Mg(OH)₂沉淀,两种沉淀同时存在,无法通过滤渣质量单独计算K₂CO₃的质量,不合理。
D. 加入足量BaCl₂溶液,只有K₂CO₃与BaCl₂反应生成BaCO₃沉淀(KOH、KCl与BaCl₂不反应)。过滤、洗涤、干燥后称BaCO₃质量,根据化学方程式可计算出K₂CO₃质量,进而求出质量分数,合理。
结论:D
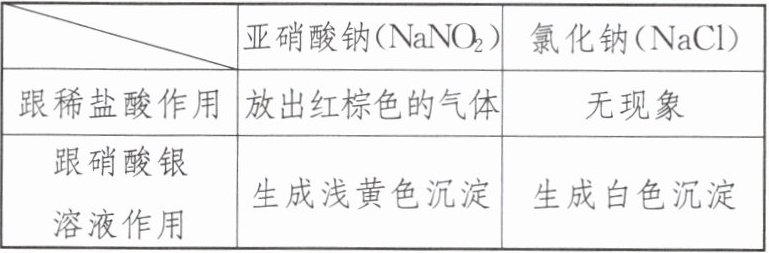
5. 陈女士一家六口误食亚硝酸盐中毒,被送往医院紧急治疗。亚硝酸钠外观酷似食盐,有咸味,加热会分解,放出有臭味的气体。请根据下表判断,下列区别亚硝酸钠和氯化钠方法错误的是 ( )
| | 亚硝酸钠($NaNO_2$) | 氯化钠($NaCl$) |
| 跟稀盐酸作用 | 放出红棕色的气体 | 无现象 |
| 跟硝酸银溶液作用 | 生成浅黄色沉淀 | 生成白色沉淀 |
A.滴加稀盐酸
B.加热
C.滴加硝酸银溶液
D.加水溶解
| | 亚硝酸钠($NaNO_2$) | 氯化钠($NaCl$) |
| 跟稀盐酸作用 | 放出红棕色的气体 | 无现象 |
| 跟硝酸银溶液作用 | 生成浅黄色沉淀 | 生成白色沉淀 |

A.滴加稀盐酸
B.加热
C.滴加硝酸银溶液
D.加水溶解
答案:
D
6. 下列生活中常见的盐与其对应的用途描述不相符的是 ( )
A.氯化钠是常用的调味品
B.硫酸铜是一种泻药的成分
C.硫酸钡是“钡餐”的主要成分
D.磷酸二氢钙可以作为磷肥
A.氯化钠是常用的调味品
B.硫酸铜是一种泻药的成分
C.硫酸钡是“钡餐”的主要成分
D.磷酸二氢钙可以作为磷肥
答案:
B
7. 如图是几种常见的盐,请回答下列问题:
硫酸铜粉末
碳酸钠粉末
碳酸钙粉末
氯化钙粉末

(1) 将四种固体放入水中,可以判定是硫酸铜的证据是______。
(2) 碳酸钙、碳酸钠均能与稀盐酸反应生成$CO_2$,是因为碳酸钙、碳酸钠中均含有______(填离子符号)。
(3) 在碳酸钠溶液中滴加氯化钙溶液,现象是______。
硫酸铜粉末
碳酸钠粉末
碳酸钙粉末
氯化钙粉末

(1) 将四种固体放入水中,可以判定是硫酸铜的证据是______。
(2) 碳酸钙、碳酸钠均能与稀盐酸反应生成$CO_2$,是因为碳酸钙、碳酸钠中均含有______(填离子符号)。
(3) 在碳酸钠溶液中滴加氯化钙溶液,现象是______。
答案:
(1)形成蓝色溶液
(2)$CO_3^{2 - }$
(3)产生白色沉淀
(1)形成蓝色溶液
(2)$CO_3^{2 - }$
(3)产生白色沉淀
查看更多完整答案,请扫码查看


