第27页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
8. 某科学兴趣小组为探究铝和铜的金属活动性强弱,开展了以下探究活动。
| 编 号 | 操 作 | 现 象 |
| 甲 | 将表面未打磨的铝丝浸入 $CuSO_4$ 溶液中 | 无明显现象 |
| 乙 | 将表面打磨后的铝丝浸入 $CuSO_4$ 溶液中 | 铝丝表面析出红色固体 |
| 丙 | 将表面未打磨的铝丝浸入 $CuCl_2$ 溶液中 | 铝丝表面析出红色固体 |
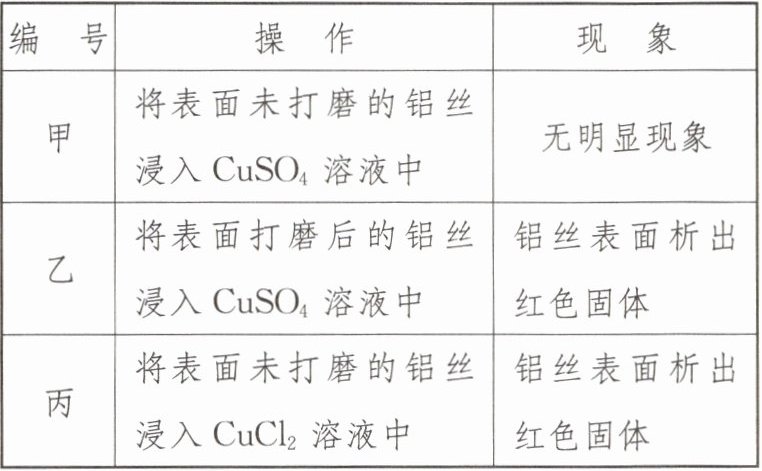
(1)比较实验乙和实验______(填“甲”或“丙”)可知:打磨能破坏氧化铝薄膜。
(2)实验乙中反应的化学方程式为______,据此可知金属活动性 Al 比 Cu 强。
(3)查阅资料得知:$CuSO_4$ 溶液中有 $Cu^{2+}$、$SO_4^{2-}$、$H_2O$ 三种粒子,$CuCl_2$ 溶液中有 $Cu^{2+}$、$Cl^-$、$H_2O$ 三种粒子。下列是某同学对实验丙的现象进行的分析,你认为下列猜想合理的是______(填字母)。
A. $H_2O$ 破坏了氧化铝膜
B. $Cl^-$ 破坏了氧化铝膜
C. $Cu^{2+}$ 破坏了氧化铝膜
D. $SO_4^{2-}$ 破坏了氧化铝膜
| 编 号 | 操 作 | 现 象 |
| 甲 | 将表面未打磨的铝丝浸入 $CuSO_4$ 溶液中 | 无明显现象 |
| 乙 | 将表面打磨后的铝丝浸入 $CuSO_4$ 溶液中 | 铝丝表面析出红色固体 |
| 丙 | 将表面未打磨的铝丝浸入 $CuCl_2$ 溶液中 | 铝丝表面析出红色固体 |

(1)比较实验乙和实验______(填“甲”或“丙”)可知:打磨能破坏氧化铝薄膜。
(2)实验乙中反应的化学方程式为______,据此可知金属活动性 Al 比 Cu 强。
(3)查阅资料得知:$CuSO_4$ 溶液中有 $Cu^{2+}$、$SO_4^{2-}$、$H_2O$ 三种粒子,$CuCl_2$ 溶液中有 $Cu^{2+}$、$Cl^-$、$H_2O$ 三种粒子。下列是某同学对实验丙的现象进行的分析,你认为下列猜想合理的是______(填字母)。
A. $H_2O$ 破坏了氧化铝膜
B. $Cl^-$ 破坏了氧化铝膜
C. $Cu^{2+}$ 破坏了氧化铝膜
D. $SO_4^{2-}$ 破坏了氧化铝膜
答案:
甲;$2Al + 3CuSO_4 = Al_2(SO_4)_3 + 3Cu$;B
9. 我国西北地区有很多咸水湖,其中最大的是柴达木盆地的察尔汗盐池。某盐湖附近的农民通过“冬天捞碱,夏天晒盐”获得大量湖盐。小科取该湖盐样品进行探究。
[提出问题]该湖盐样品的成分是什么?
[查阅资料]冬天捞碱的“碱”指 $Na_2CO_3$,夏天晒盐的“盐”指 NaCl。
[猜想与假设]猜想一:$Na_2CO_3$;猜想二:NaCl;猜想三:$Na_2CO_3$ 和 NaCl。
[实验探究]
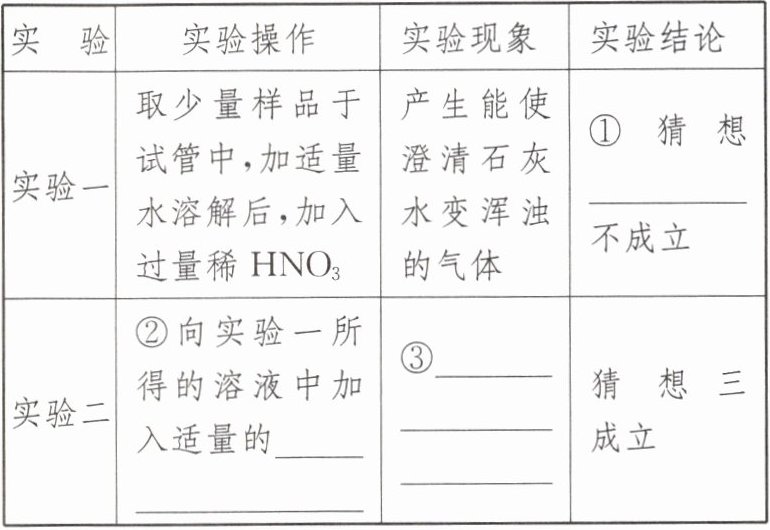
| 实 验 | 实验操作 | 实验现象 | 实验结论 |
| 实验一 | 取少量样品于试管中,加适量水溶解后,加入过量稀 $HNO_3$ | 产生能使澄清石灰水变浑浊的气体 | ① 猜想______不成立 |
| 实验二 | ② 向实验一所得的溶液中加入适量的______ | ③ ______ | 猜想三成立 |
[拓展延伸]为进一步确定该湖盐样品中 $Na_2CO_3$ 的质量分数,小科再取该湖盐样品 10.00 g 做了如图所示的补充实验。
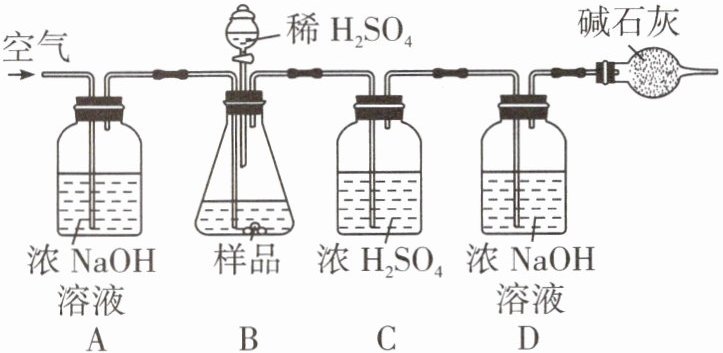
(1)反应结束之后通入空气的目的是______。
(2)装置 A 中浓 NaOH 溶液的作用是______(用化学方程式表示)。
(3)实验结束后测得装置 D 增重 0.44 g,则湖盐样品中 $Na_2CO_3$ 的质量分数为多少?
[提出问题]该湖盐样品的成分是什么?
[查阅资料]冬天捞碱的“碱”指 $Na_2CO_3$,夏天晒盐的“盐”指 NaCl。
[猜想与假设]猜想一:$Na_2CO_3$;猜想二:NaCl;猜想三:$Na_2CO_3$ 和 NaCl。
[实验探究]
| 实 验 | 实验操作 | 实验现象 | 实验结论 |
| 实验一 | 取少量样品于试管中,加适量水溶解后,加入过量稀 $HNO_3$ | 产生能使澄清石灰水变浑浊的气体 | ① 猜想______不成立 |
| 实验二 | ② 向实验一所得的溶液中加入适量的______ | ③ ______ | 猜想三成立 |

[拓展延伸]为进一步确定该湖盐样品中 $Na_2CO_3$ 的质量分数,小科再取该湖盐样品 10.00 g 做了如图所示的补充实验。

(1)反应结束之后通入空气的目的是______。
(2)装置 A 中浓 NaOH 溶液的作用是______(用化学方程式表示)。
(3)实验结束后测得装置 D 增重 0.44 g,则湖盐样品中 $Na_2CO_3$ 的质量分数为多少?
答案:
[实验探究]
① 二
② 硝酸银溶液
③ 产生白色沉淀
[拓展延伸]
(1) 将装置内残留的二氧化碳全部排入D装置被吸收
(2) $2NaOH + CO_2 = Na_2CO_3 + H_2O$
(3) 解:设湖盐样品中$Na_2CO_3$的质量为$x$。
$Na_2CO_3 + H_2SO_4 = Na_2SO_4 + H_2O + CO_2\uparrow$
106 44
$x$ 0.44g
$\frac{106}{44} = \frac{x}{0.44g}$
$x = 1.06g$
湖盐样品中$Na_2CO_3$的质量分数为$\frac{1.06g}{10.00g} × 100\% = 10.6\%$
答:湖盐样品中$Na_2CO_3$的质量分数为10.6%。
① 二
② 硝酸银溶液
③ 产生白色沉淀
[拓展延伸]
(1) 将装置内残留的二氧化碳全部排入D装置被吸收
(2) $2NaOH + CO_2 = Na_2CO_3 + H_2O$
(3) 解:设湖盐样品中$Na_2CO_3$的质量为$x$。
$Na_2CO_3 + H_2SO_4 = Na_2SO_4 + H_2O + CO_2\uparrow$
106 44
$x$ 0.44g
$\frac{106}{44} = \frac{x}{0.44g}$
$x = 1.06g$
湖盐样品中$Na_2CO_3$的质量分数为$\frac{1.06g}{10.00g} × 100\% = 10.6\%$
答:湖盐样品中$Na_2CO_3$的质量分数为10.6%。
查看更多完整答案,请扫码查看


