第69页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
2. 在反应A+B= C+2D中,29gA可跟49gB完全反应,生成18gD,C的相对分子质量为120,则A的相对分子质量为(
A.58
B.26
C.40
D.86
A
)A.58
B.26
C.40
D.86
答案:
A
3. 已知:某密闭容器中,12gA加热完全分解产生B和C,其中B的质量为2g,同时C又能部分分解产生0.1gD和7.9gE,则最终该密闭容器中B和C的质量比为(
A.1:1
B.1:2
C.1:4
D.1:5
1:1
)A.1:1
B.1:2
C.1:4
D.1:5
答案:
解析:选A。参加反应的A的质量等于生成的B和C的质量之和,参加反应的A的质量为12g,生成B的质量为2g,则同时生成C的质量为10g,C又能部分分解产生0.1gD和7.9gE,则反应掉C的质量为0.1g+7.9g=8g,还剩余C的质量为2g,则最终密闭容器内B的质量为2g,C的质量为2g,质量比为1:1。
4. 甲酸(HCOOH)具有清洁制氢的巨大潜力,其分解前后分子种类变化的微观示意图如下:
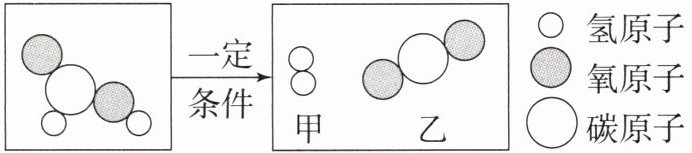
求:若要制得2g氢气,需要甲酸的质量为多少?

求:若要制得2g氢气,需要甲酸的质量为多少?
解:设需要甲酸的质量为x。HCOOH$\frac{\underline{一定条件}}{}$H₂↑+CO₂↑46 2x 2g$\frac{46}{2}$=$\frac{x}{2\mathrm{g}}$x=46g答:需要甲酸的质量为46g。
答案:
解:设需要甲酸的质量为x。HCOOH$\frac{\underline{一定条件}}{}$H₂↑+CO₂↑46 2x 2g$\frac{46}{2}$=$\frac{x}{2\mathrm{g}}$x=46g答:需要甲酸的质量为46g。
5. 杭州亚运会开幕式上主火炬的燃料——甲醇($CH_3OH$)是通过$CO_2$绿色循环利用合成的,反应过程为$CO_2 + 3H_2 \xlongequal{催化剂} CH_3OH + H_2O$。本次亚运会共使用320t零碳甲醇,理论上制取320t零碳甲醇要消耗二氧化碳的质量为多少?
答案:
解:设要消耗二氧化碳的质量为x。CO₂+3H₂$\frac{\underline{催化剂}}{}$CH₃OH+H₂O44 32x 320t$\frac{44}{32}$=$\frac{x}{320\mathrm{t}}$x=440t答:要消耗二氧化碳的质量为440t。
6. 实验室里用8.0g粗锌与足量稀硫酸反应制得氢气0.2g,该反应的化学方程式为$Zn + H_2SO_4 = ZnSO_4 + H_2↑$(粗锌所含的杂质不跟稀硫酸反应)。
(1)硫酸($H_2SO_4$)中硫、氧元素的质量比是
(2)列式计算粗锌中锌的质量分数。
(1)硫酸($H_2SO_4$)中硫、氧元素的质量比是
1:2
。(2)列式计算粗锌中锌的质量分数。
答案:
(1)1:2
(2)解:设参加反应的锌的质量为x。Zn+H₂SO₄$\xlongequal{}$ZnSO₄+H₂↑65 2x 0.2g$\frac{65}{2}$=$\frac{x}{0.2\mathrm{g}}$x=6.5g粗锌中锌的质量分数为$\frac{6.5\mathrm{g}}{8\mathrm{g}}$×100%=81.25%答:粗锌中锌的质量分数为81.25%。
(1)1:2
(2)解:设参加反应的锌的质量为x。Zn+H₂SO₄$\xlongequal{}$ZnSO₄+H₂↑65 2x 0.2g$\frac{65}{2}$=$\frac{x}{0.2\mathrm{g}}$x=6.5g粗锌中锌的质量分数为$\frac{6.5\mathrm{g}}{8\mathrm{g}}$×100%=81.25%答:粗锌中锌的质量分数为81.25%。
查看更多完整答案,请扫码查看


