2025年赢在高考假期作业必刷题高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年赢在高考假期作业必刷题高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
1. $ N_{A} $ 代表阿伏加德罗常数的值。下列说法错误的是 (
A.1 mol 过氧化钠中阴离子数目为 $ 2N_{A} $
B.$ 32 \mathrm{~g} \mathrm{O}_{3} $ 和 $ \mathrm{O}_{2} $ 的混合物中含有氧原子的数目为 $ 2N_{A} $
C.2 mol 氦气中所含原子数目为 $ 2N_{A} $
D.$ 0.5 \mathrm{~mol} \mathrm{OH}^{-} $ 中所含有电子数目为 $ 5N_{A} $
A
)A.1 mol 过氧化钠中阴离子数目为 $ 2N_{A} $
B.$ 32 \mathrm{~g} \mathrm{O}_{3} $ 和 $ \mathrm{O}_{2} $ 的混合物中含有氧原子的数目为 $ 2N_{A} $
C.2 mol 氦气中所含原子数目为 $ 2N_{A} $
D.$ 0.5 \mathrm{~mol} \mathrm{OH}^{-} $ 中所含有电子数目为 $ 5N_{A} $
答案:
1. A [A. 过氧化钠中含有钠离子和过氧根离子,1 mol 过氧化钠含有 $ N_A $ 个阴离子,A 错误;B. $ O_2 $ 和 $ O_3 $ 都是由 O 原子构成的,O 原子相对原子质量是 16,则 32 g $ O_2 $ 和 $ O_3 $ 的混合物中含有的氧原子物质的量是 $ n(O)=\frac{32 g}{16 g/mol}=2 mol $,因此混合气体中含有 O 原子的数目是 $ 2N_A $,B 正确;C. He 为单原子气体,2 mol 氦气中所含原子数目为 $ 2N_A $,C 正确;D. 一个 $ OH^- $ 中含有电子数目为 10,0.5 mol $ OH^- $ 中所含有电子数目为 $ 5N_A $,D 正确;故选 A。]
2. 设 $ N_{A} $ 为阿伏加德罗常数的值,下列说法正确的是 (
A.在标准状况下, $ 22.4 \mathrm{~L} \mathrm{CO} $ 和 $ \mathrm{CO}_{2} $ 的混合气体所含碳原子数约为 $ N_{A} $
B.常温常压下, $ 32 \mathrm{~g} \mathrm{SO}_{2} $ 与标准状况下 $ 11.2 \mathrm{~L} $ 氮气含有相同的原子数
C.氨气的摩尔质量等于 $ N_{A} $ 个氨分子的质量之和
D.标准状况下, $ 2N_{A} $ 个 $ \mathrm{H}_{2} \mathrm{O} $ 的体积约为 $ 44.8 \mathrm{~L} $
A
)A.在标准状况下, $ 22.4 \mathrm{~L} \mathrm{CO} $ 和 $ \mathrm{CO}_{2} $ 的混合气体所含碳原子数约为 $ N_{A} $
B.常温常压下, $ 32 \mathrm{~g} \mathrm{SO}_{2} $ 与标准状况下 $ 11.2 \mathrm{~L} $ 氮气含有相同的原子数
C.氨气的摩尔质量等于 $ N_{A} $ 个氨分子的质量之和
D.标准状况下, $ 2N_{A} $ 个 $ \mathrm{H}_{2} \mathrm{O} $ 的体积约为 $ 44.8 \mathrm{~L} $
答案:
2. A [A. 在标准状况下,22.4 L CO 和 $ CO_2 $ 的混合气体分子的物质的量为 $ \frac{22.4 L}{22.4 L/mol}=1 mol $,所含碳原子数约为 $ N_A $,A 正确;B. 常温常压下,32 g $ SO_2 $ 的物质的量为 $ \frac{32 g}{64 g/mol}=0.5 mol $,则所含原子数为 $ 0.5 mol×3×N_A mol^{-1}=1.5N_A $,标准状况下 11.2 L 氮气的物质的量为 $ \frac{11.2 L}{22.4 L/mol}=0.5 mol $,则氮气分子中含有的原子数为 $ 0.5 mol×2×N_A mol^{-1}=N_A $,B 错误;C. 氨气的摩尔质量单位为 g/mol 时,在数值上等于 $ N_A $ 个氨分子的质量之和,C 错误;D. 标准状况下,$ H_2O $ 为非气态物质,$ 2N_A $ 个 $ H_2O $ 为 2 mol,在标准状况下的体积不是 44.8 L,D 错误;故选 A。]【特别提醒】气体摩尔体积 $ (22.4 L·mol^{-1}) $应用的“五大误区”
(1)使用“条件”是标准状况,即 $ 0℃ $、101 kPa,而不是常温、常压。
(2)使用对象必须是气体物质,可以是单一气体,也可以是混合气体。标准状况下不是气体而又常在题中出现的物质有:水、苯、$ SO_3 $、HF、$ CCl_4 $、己烷、$ CS_2 $、$ CHCl_3 $、$ Br_2 $、乙醇等。
(3)标准状况下的气体摩尔体积约为 $ 22.4 L·mol^{-1} $,其他条件下 $ V_m $ 一般不是 $ 22.4 L·mol^{-1} $。
(4)22.4 L 气体,在标准状况下的物质的量是 1 mol,在非标准状况下,可能是 1 mol,也可能不是 1 mol。
(5)物质的质量、物质的量一定时,所含微粒数与物质处于何种条件无关。如常温常压下 32 g $ O_2 $ 所含的原子数目是 $ 2N_A $。注意不要形成定势思维,看到“常温常压”就排除选项。
(1)使用“条件”是标准状况,即 $ 0℃ $、101 kPa,而不是常温、常压。
(2)使用对象必须是气体物质,可以是单一气体,也可以是混合气体。标准状况下不是气体而又常在题中出现的物质有:水、苯、$ SO_3 $、HF、$ CCl_4 $、己烷、$ CS_2 $、$ CHCl_3 $、$ Br_2 $、乙醇等。
(3)标准状况下的气体摩尔体积约为 $ 22.4 L·mol^{-1} $,其他条件下 $ V_m $ 一般不是 $ 22.4 L·mol^{-1} $。
(4)22.4 L 气体,在标准状况下的物质的量是 1 mol,在非标准状况下,可能是 1 mol,也可能不是 1 mol。
(5)物质的质量、物质的量一定时,所含微粒数与物质处于何种条件无关。如常温常压下 32 g $ O_2 $ 所含的原子数目是 $ 2N_A $。注意不要形成定势思维,看到“常温常压”就排除选项。
3. 下列有关气体的说法正确的是 (
A.在非标准状况下,气体的摩尔体积不可能是 $ 22.4 \mathrm{~L} / \mathrm{mol} $
B.$ 1 \mathrm{~mol} \mathrm{HCl} $ 气体溶于 $ 1 \mathrm{~L} \mathrm{H}_{2} \mathrm{O} $ 中,所得溶液物质的量浓度为 $ 1 \mathrm{~mol} / \mathrm{L} $
C.在同温同容条件下,等质量的 $ \mathrm{O}_{2} $ 和 $ \mathrm{SO}_{2} $ 的压强比为 $ 2: 1 $
D.在同温同压条件下, $ \mathrm{CO} $ 和 $ \mathrm{CO}_{2} $ 的密度比为 $ 11: 7 $
C
)A.在非标准状况下,气体的摩尔体积不可能是 $ 22.4 \mathrm{~L} / \mathrm{mol} $
B.$ 1 \mathrm{~mol} \mathrm{HCl} $ 气体溶于 $ 1 \mathrm{~L} \mathrm{H}_{2} \mathrm{O} $ 中,所得溶液物质的量浓度为 $ 1 \mathrm{~mol} / \mathrm{L} $
C.在同温同容条件下,等质量的 $ \mathrm{O}_{2} $ 和 $ \mathrm{SO}_{2} $ 的压强比为 $ 2: 1 $
D.在同温同压条件下, $ \mathrm{CO} $ 和 $ \mathrm{CO}_{2} $ 的密度比为 $ 11: 7 $
答案:
3. C [A. 影响气体物质的量的因素有温度、压强,因此在非标准状况下,气体的摩尔体积也可能是 22.4 L/mol,A 错误;B. 1 mol HCl 气体溶于 1 L $ H_2O $ 中,所得溶液的体积不是 1 L,溶液物质的量浓度不是 1 mol/L,B 错误;C. 据 $ pV = nRT $ 可知,在同温同容条件下,气体的压强比等于物质的量之比,等质量的 $ O_2 $ 和 $ SO_2 $ 的压强比为 $ 2:1 $,C 正确;D. 据 $ pV = nRT $ 有,$ pM=\frac{m}{V}RT=\rho RT $,因此在同温、同压条件下,气体的密度比等于摩尔质量之比,CO 和 $ CO_2 $ 的密度比为 $ 7:11 $,D 错误;故选 C。]
4. (2025·福建三明·期中)下列叙述正确的是 (
A.$ 1 \mathrm{~L} $ 水中溶解 $ 40 \mathrm{~g} \mathrm{NaOH} $ 固体后,所得溶液的物质的量浓度为 $ 1 \mathrm{~mol} \cdot \mathrm{L}^{-1} $
B.配制 $ 1 \mathrm{~L} 0.2 \mathrm{~mol} \cdot \mathrm{L}^{-1} $ 的 $ \mathrm{CuSO}_{4} $ 溶液,需用 $ 32.0 \mathrm{~g} $ 胆矾
C.将标准状况下 $ 2.24 \mathrm{~L} \mathrm{HCl} $ 气体溶于水制成 $ 100 \mathrm{~mL} $ 溶液,其物质的量浓度为 $ 1 \mathrm{~mol} \cdot \mathrm{L}^{-1} $
D.用密度为 $ 1.84 \mathrm{~g} \cdot \mathrm{mL}^{-1} $, 质量分数为 $ 98 \% $ 的浓硫酸配制 $ 1 \mathrm{~mol} \cdot \mathrm{L}^{-1} $ 的稀硫酸 $ 100 \mathrm{~mL} $, 需要用量筒量取该浓硫酸 $ 5.42 \mathrm{~mL} $
C
)A.$ 1 \mathrm{~L} $ 水中溶解 $ 40 \mathrm{~g} \mathrm{NaOH} $ 固体后,所得溶液的物质的量浓度为 $ 1 \mathrm{~mol} \cdot \mathrm{L}^{-1} $
B.配制 $ 1 \mathrm{~L} 0.2 \mathrm{~mol} \cdot \mathrm{L}^{-1} $ 的 $ \mathrm{CuSO}_{4} $ 溶液,需用 $ 32.0 \mathrm{~g} $ 胆矾
C.将标准状况下 $ 2.24 \mathrm{~L} \mathrm{HCl} $ 气体溶于水制成 $ 100 \mathrm{~mL} $ 溶液,其物质的量浓度为 $ 1 \mathrm{~mol} \cdot \mathrm{L}^{-1} $
D.用密度为 $ 1.84 \mathrm{~g} \cdot \mathrm{mL}^{-1} $, 质量分数为 $ 98 \% $ 的浓硫酸配制 $ 1 \mathrm{~mol} \cdot \mathrm{L}^{-1} $ 的稀硫酸 $ 100 \mathrm{~mL} $, 需要用量筒量取该浓硫酸 $ 5.42 \mathrm{~mL} $
答案:
4. C [A. 溶液的体积不是 1 L,不能计算浓度,A 错误;B. 配制 1 L $ 0.2 mol·L^{-1} $ 的 $ CuSO_4 $ 溶液,需用胆矾 $ 1 L×0.2 mol·L^{-1}×250 g/mol = 50 g $,B 错误;C. 标准状况下,2.24 L HCl 气体的物质的量为 0.1 mol,溶液体积为 0.1 L,浓度为 1 mol/L,C 正确;D. 根据公式 $ c=\frac{1000\rho w}{M} $,密度为 $ 1.84 g·mL^{-1} $,质量分数为 98% 的浓硫酸的浓度为 $ 18.4 mol·L^{-1} $,配制 $ 1 mol·L^{-1} $ 的稀硫酸 100 mL,需要浓硫酸 5.42 mL,则要用量筒量取该浓硫酸 5.4 mL,D 错误;故选 C。]
5. (2025·河南郑州·阶段练习)把 $ 200 \mathrm{~mL} $ 含有 $ \mathrm{BaCl}_{2} $ 和 $ \mathrm{KCl} $ 的混合溶液分成 2 等份,取一份加入含 $ a \mathrm{~mol} $ 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含 $ b \mathrm{~mol} $ 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为 (
A.$ 5(b-2 a) \mathrm{mol} \cdot \mathrm{L}^{-1} $
B.$ 10(2 a-b) \mathrm{mol} \cdot \mathrm{L}^{-1} $
C.$ 10(b-a) \mathrm{mol} \cdot \mathrm{L}^{-1} $
D.$ 10(b-2 a) \mathrm{mol} \cdot \mathrm{L}^{-1} $
D
)A.$ 5(b-2 a) \mathrm{mol} \cdot \mathrm{L}^{-1} $
B.$ 10(2 a-b) \mathrm{mol} \cdot \mathrm{L}^{-1} $
C.$ 10(b-a) \mathrm{mol} \cdot \mathrm{L}^{-1} $
D.$ 10(b-2 a) \mathrm{mol} \cdot \mathrm{L}^{-1} $
答案:
5. D [混合溶液分成 2 等份,每份溶液浓度相同,一份加入含 a mol 硫酸钠的溶液,发生反应 $ Ba^{2+}+SO_4^{2-}=BaSO_4↓ $,恰好使钡离子完全沉淀,可知该份中 $ n(Ba^{2+}) = n(Na_2SO_4) = a mol $;另一份加入含 b mol 硝酸银的溶液,发生反应 $ Ag^+ + Cl^- = AgCl↓ $,恰好使氯离子完全沉淀,则 $ n(Cl^-) = n(Ag^+) = b mol $,根据电荷守恒可知每份中满足:$ 2n(Ba^{2+}) + n(K^+) = n(Cl^-) $,每份溶液中:$ n(K^+) = b mol - 2a mol = (b - 2a)mol $,故钾离子浓度为 $ \frac{(b - 2a)mol}{0.2 L×\frac{1}{2}} = 10(b - 2a) mol/L $;故选 D。]
6. 配制 $ 450 \mathrm{~mL} 1 \mathrm{~mol} / \mathrm{L} $ 的 $ \mathrm{NaCl} $ 溶液,部分实验操作示意图如下:
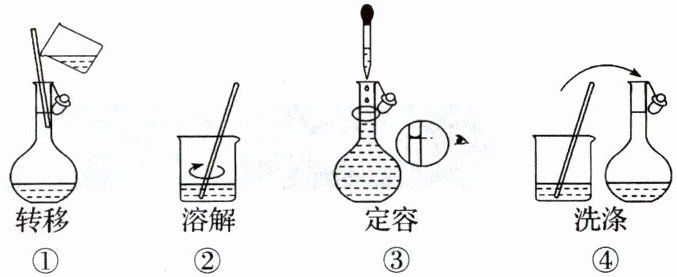
下列说法正确的是 (
A.实验中需用的仪器有天平、$ 450 \mathrm{~mL} $ 容量瓶、烧杯、玻璃棒、胶头滴管等
B.上述实验操作步骤的正确顺序为①②④③
C.用托盘天平称量 $ \mathrm{NaCl} $ 固体的质量为 $ 29.25 \mathrm{~g} $
D.定容时,仰视容量瓶的刻度线,使配得的 $ \mathrm{NaCl} $ 溶液浓度偏低

下列说法正确的是 (
D
)A.实验中需用的仪器有天平、$ 450 \mathrm{~mL} $ 容量瓶、烧杯、玻璃棒、胶头滴管等
B.上述实验操作步骤的正确顺序为①②④③
C.用托盘天平称量 $ \mathrm{NaCl} $ 固体的质量为 $ 29.25 \mathrm{~g} $
D.定容时,仰视容量瓶的刻度线,使配得的 $ \mathrm{NaCl} $ 溶液浓度偏低
答案:
6. D [A. 配制 450 mL 0.100 NaCl 溶液用到的仪器有托盘天平、药匙、烧杯、玻璃棒、500 mL 容量瓶、胶头滴管,A 错误;B. 配制一定物质的量浓度的溶液的步骤有计算、称量、溶解、转移、洗涤、定容、摇匀等,操作步骤正确的顺序为 ②①④③,B 错误;C. 托盘天平精确度为 0.1 g,称取 NaCl 的质量为 29.3 g,C 错误;D. 定容时仰视容量瓶的刻度线,则所加蒸馏水偏多,溶液的体积偏大,溶液的浓度偏低,D 正确;故选 D。]
查看更多完整答案,请扫码查看


