2025年赢在高考假期作业必刷题高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年赢在高考假期作业必刷题高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
6. (2025·湖北·期中)几种物质在水溶液中的转化关系如下图所示(依次发生反应1、2、3)
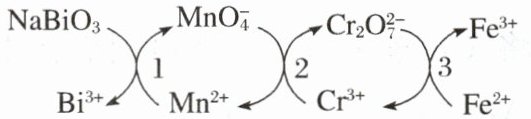
已知:$NaBiO_{3}$微溶于水,下列叙述错误的是 (
A.反应1的离子方程式为:$5BiO_{3}^{-}+2Mn^{2+}+14H^{+}= 5Bi^{3+}+2MnO_{4}^{-}+7H_{2}O$
B.反应2说明氧化性:$MnO_{4}^{-}>Cr_{2}O_{7}^{2-}$
C.反应3中,生成16.8g$Fe^{3+}$时消耗0.05mol$Cr_{2}O_{7}^{2-}$
D.上述反应说明还原性:$Fe^{2+}>Cr^{3+}>Mn^{2+}>Bi^{3+}$

已知:$NaBiO_{3}$微溶于水,下列叙述错误的是 (
A
)A.反应1的离子方程式为:$5BiO_{3}^{-}+2Mn^{2+}+14H^{+}= 5Bi^{3+}+2MnO_{4}^{-}+7H_{2}O$
B.反应2说明氧化性:$MnO_{4}^{-}>Cr_{2}O_{7}^{2-}$
C.反应3中,生成16.8g$Fe^{3+}$时消耗0.05mol$Cr_{2}O_{7}^{2-}$
D.上述反应说明还原性:$Fe^{2+}>Cr^{3+}>Mn^{2+}>Bi^{3+}$
答案:
A [A. 反应 1 中铋元素的化合价由 +5 价变成 +3 价,锰的化合价由 +2 价变成 +7 价,由于 $NaBiO_{3}$ 微溶于水,根据得失电子守恒可知,离子方程式为:$5NaBiO_{3}+2Mn^{2+}+14H^{+}=5Bi^{3+}+5Na^{+}+2MnO_{4}^{-}+7H_{2}O$,A 错误;B. 反应 2 中锰元素化合价降低,$MnO_{4}^{-}$ 为氧化剂,铬元素化合价升高,$Cr_{2}O_{7}^{2-}$ 为氧化产物,氧化剂的氧化性大于氧化产物,氧化性:$MnO_{4}^{-}>Cr_{2}O_{7}^{2-}$,B 正确;C. 1 mol $Cr_{2}O_{7}^{2-}$ 被还原成 $Cr^{3+}$,共转移 6 mol 电子;6 mol $Fe^{2+}$ 完全被氧化成 $Fe^{3+}$,共转移 6 mol 电子,所以 1 mol $Cr_{2}O_{7}^{2-}$ 能氧化 6 mol $Fe^{2+}$,16.8 g $Fe^{3+}$ 的物质的量为 0.3 mol,则生成 16.8 g $Fe^{3+}$ 时消耗 0.05 mol $Cr_{2}O_{7}^{2-}$,C 正确;D. 根据还原剂的还原性大于还原产物,结合方程式 1、2、3 可知,还原性:$Fe^{2+}>Cr^{3+}>Mn^{2+}>Bi^{3+}$,D 正确;故选 A。]
(2024·浙江6月卷)利用$CH_{3}OH可将废水中的NO_{3}^{-}$转化为对环境无害的物质后排放。反应原理为:$H^{+}+CH_{3}OH+NO_{3}^{-}→X+CO_{2}+H_{2}O$(未配平)。下列说法正确的是 (
A.X表示$NO_{2}$
B.可用$O_{3}替换CH_{3}OH$
C.氧化剂与还原剂物质的量之比为$6:5$
D.若生成标准状况下的$CO_{2}$气体11.2L,则反应转移的电子数为$2N_{A}$($N_{A}$表示阿伏加德罗常数的值)
C
)A.X表示$NO_{2}$
B.可用$O_{3}替换CH_{3}OH$
C.氧化剂与还原剂物质的量之比为$6:5$
D.若生成标准状况下的$CO_{2}$气体11.2L,则反应转移的电子数为$2N_{A}$($N_{A}$表示阿伏加德罗常数的值)
答案:
C [A. 由题中信息可知,利用 $CH_{3}OH$ 可将废水中的 $NO_{3}^{-}$ 转化为对环境无害的物质 X 后排放,则 X 表示 $N_{2}$,$NO_{2}$ 仍然是大气污染物,A 不正确;B. $CH_{3}OH$ 中 C 元素的化合价由 -2 价升高到 +4 价,$CH_{3}OH$ 是该反应的还原剂,$O_{3}$ 有强氧化性,通常不能用作还原剂,故不可用 $O_{3}$ 替换 $CH_{3}OH$,B 不正确;C. 该反应中,还原剂 $CH_{3}OH$ 中 C 元素的化合价由 -2 价升高到 +4 价,升高了 6 个价位,氧化剂 $NO_{3}^{-}$ 中 N 元素的化合价由 +5 价降低到 0 价,降低了 5 个价位,由电子转移守恒可知,氧化剂与还原剂的物质的量之比为 6:5,C 正确;D. $CH_{3}OH$ 中 C 元素的化合价由 -2 价升高到 +4 价,升高了 6 个价位,若生成标准状况下的 $CO_{2}$ 气体 11.2 L,即生成 0.5 mol $CO_{2}$,反应转移的电子数为 $0.5mol×6N_{A}\cdot mol^{-1}=3N_{A}$,D 不正确;故选 C。]
(2025·四川·期中)二氧化铈($CeO_{2}$)是一种重要的稀土化合物。提纯二氧化铈的一种工艺流程如图所示: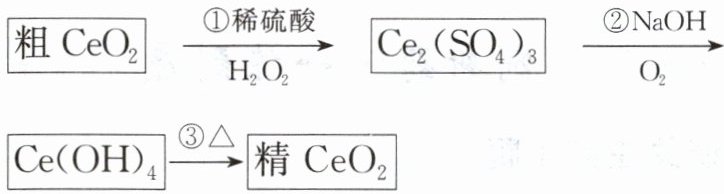
已知:$Ce_{2}(SO_{4})_{3}$可溶于水,$Ce(OH)_{4}$为难溶物。
试回答以下问题:
(1)$CeO_{2}$中Ce的化合价为____,反应③是否为氧化还原反应____(填“是”或“否”)。
(2)反应②中氧化剂与还原剂的物质的量之比为____,消耗1个$O_{2}$转移的电子数为____。
(3)在反应①中$H_{2}O_{2}$体现____(填“氧化性”或“还原性”),写出反应①的离子方程式____。
(4)结合题中信息及所学知识,判断$CeO_{2}$、$Ce(OH)_{4}$、$H_{2}O_{2}$、$O_{2}$氧化性由强到弱的顺序是____。
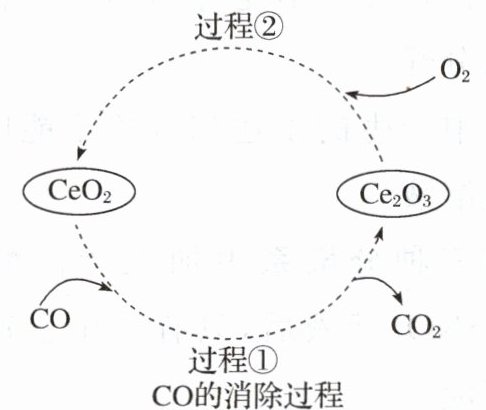
(5)$CeO_{2}$是汽车尾气净化催化剂中最重要的助剂,工作原理如图所示。写出过程①发生反应的化学方程式,并用单线桥表示电子转移的方向与数目____。

已知:$Ce_{2}(SO_{4})_{3}$可溶于水,$Ce(OH)_{4}$为难溶物。
试回答以下问题:
(1)$CeO_{2}$中Ce的化合价为____,反应③是否为氧化还原反应____(填“是”或“否”)。
(2)反应②中氧化剂与还原剂的物质的量之比为____,消耗1个$O_{2}$转移的电子数为____。
(3)在反应①中$H_{2}O_{2}$体现____(填“氧化性”或“还原性”),写出反应①的离子方程式____。
(4)结合题中信息及所学知识,判断$CeO_{2}$、$Ce(OH)_{4}$、$H_{2}O_{2}$、$O_{2}$氧化性由强到弱的顺序是____。
(5)$CeO_{2}$是汽车尾气净化催化剂中最重要的助剂,工作原理如图所示。写出过程①发生反应的化学方程式,并用单线桥表示电子转移的方向与数目____。

答案:
解析 粗 $CeO_{2}$ 在稀硫酸条件下与双氧水发生氧化还原反应生成 $Ce_{2}(SO_{4})_{3}$ 和氧气,$Ce_{2}(SO_{4})_{3}$ 在氢氧化钠条件下与氧气反应生成 $Ce(OH)_{4}$,$Ce(OH)_{4}$ 受热分解生成 $CeO_{2}$。
(1)根据化合物中各元素化合价代数和为 0,可算出稀土化合物 $CeO_{2}$ 中 Ce 的化合价为 +4 价;反应 ③ 是 $Ce(OH)_{4}$ 受热分解生成 $CeO_{2}$ 和水,各元素化合价不发生改变,为非氧化还原反应,答案为否。
(2)反应 ② 中的氧化剂为 $O_{2}$,1 mol $O_{2}$ 发生反应转移 4 mol 电子;还原剂为 $Ce_{2}(SO_{4})_{3}$,1 mol $Ce_{2}(SO_{4})_{3}$ 发生反应转移 2 mol 电子,根据得失电子守恒可知,氧化剂与还原剂的物质的量之比为 1:2;消耗 1 个 $O_{2}$ 转移的电子数为 4。
(3)反应 ① 中 Ce 元素化合价从 +4 价降低到 +3 价,$CeO_{2}$ 作氧化剂体现氧化性,则 $H_{2}O_{2}$ 体现还原性;反应 ① 中稀硫酸、$H_{2}O_{2}$ 与 $CeO_{2}$ 反应的离子方程式为:$2CeO_{2}+H_{2}O_{2}+6H^{+}=2Ce^{3+}+O_{2}\uparrow +4H_{2}O$。
(4)结合题中信息,$CeO_{2}$ 在酸性条件下将 $H_{2}O_{2}$ 氧化生成 $Ce_{2}(SO_{4})_{3}$ 同时生成氧气,$Ce_{2}(SO_{4})_{3}$ 在碱性条件下被氧气氧化生成 $Ce(OH)_{4}$,故判断 $CeO_{2}$、$Ce(OH)_{4}$、$H_{2}O_{2}$、$O_{2}$ 氧化性由强到弱的顺序是 $CeO_{2}>H_{2}O_{2}>O_{2}>Ce(OH)_{4}$。
(5)根据图示可知反应 ① 为 CO 和 $CeO_{2}$ 反应生成 $Ce_{2}O_{3}$ 和 $CO_{2}$,化学方程式为:$CO + 2CeO_{2}=Ce_{2}O_{3}+CO_{2}$,反应中 C 元素由 +2 价升高为 +4 价,Ce 元素由 +4 价降为 +3 价,转移电子数最小公倍数为 2。
答案
(1)+4 否
(2)1:2 4
(3)还原性 $2CeO_{2}+H_{2}O_{2}+6H^{+}=2Ce^{3+}+O_{2}\uparrow +4H_{2}O$
(4)$CeO_{2}>H_{2}O_{2}>O_{2}>Ce(OH)_{4}$
(5)
解析 粗 $CeO_{2}$ 在稀硫酸条件下与双氧水发生氧化还原反应生成 $Ce_{2}(SO_{4})_{3}$ 和氧气,$Ce_{2}(SO_{4})_{3}$ 在氢氧化钠条件下与氧气反应生成 $Ce(OH)_{4}$,$Ce(OH)_{4}$ 受热分解生成 $CeO_{2}$。
(1)根据化合物中各元素化合价代数和为 0,可算出稀土化合物 $CeO_{2}$ 中 Ce 的化合价为 +4 价;反应 ③ 是 $Ce(OH)_{4}$ 受热分解生成 $CeO_{2}$ 和水,各元素化合价不发生改变,为非氧化还原反应,答案为否。
(2)反应 ② 中的氧化剂为 $O_{2}$,1 mol $O_{2}$ 发生反应转移 4 mol 电子;还原剂为 $Ce_{2}(SO_{4})_{3}$,1 mol $Ce_{2}(SO_{4})_{3}$ 发生反应转移 2 mol 电子,根据得失电子守恒可知,氧化剂与还原剂的物质的量之比为 1:2;消耗 1 个 $O_{2}$ 转移的电子数为 4。
(3)反应 ① 中 Ce 元素化合价从 +4 价降低到 +3 价,$CeO_{2}$ 作氧化剂体现氧化性,则 $H_{2}O_{2}$ 体现还原性;反应 ① 中稀硫酸、$H_{2}O_{2}$ 与 $CeO_{2}$ 反应的离子方程式为:$2CeO_{2}+H_{2}O_{2}+6H^{+}=2Ce^{3+}+O_{2}\uparrow +4H_{2}O$。
(4)结合题中信息,$CeO_{2}$ 在酸性条件下将 $H_{2}O_{2}$ 氧化生成 $Ce_{2}(SO_{4})_{3}$ 同时生成氧气,$Ce_{2}(SO_{4})_{3}$ 在碱性条件下被氧气氧化生成 $Ce(OH)_{4}$,故判断 $CeO_{2}$、$Ce(OH)_{4}$、$H_{2}O_{2}$、$O_{2}$ 氧化性由强到弱的顺序是 $CeO_{2}>H_{2}O_{2}>O_{2}>Ce(OH)_{4}$。
(5)根据图示可知反应 ① 为 CO 和 $CeO_{2}$ 反应生成 $Ce_{2}O_{3}$ 和 $CO_{2}$,化学方程式为:$CO + 2CeO_{2}=Ce_{2}O_{3}+CO_{2}$,反应中 C 元素由 +2 价升高为 +4 价,Ce 元素由 +4 价降为 +3 价,转移电子数最小公倍数为 2。
答案
(1)+4 否
(2)1:2 4
(3)还原性 $2CeO_{2}+H_{2}O_{2}+6H^{+}=2Ce^{3+}+O_{2}\uparrow +4H_{2}O$
(4)$CeO_{2}>H_{2}O_{2}>O_{2}>Ce(OH)_{4}$
(5)

查看更多完整答案,请扫码查看


