2025年赢在高考假期作业必刷题高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年赢在高考假期作业必刷题高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
1.(2025·福建三明·期中)下列有关钠及其化合物的说法正确的是 (
A.钠与熔融$TiCl_{4}$反应冶炼钛,其中钠被还原,具有还原性
B.等质量的$Na_{2}CO_{3}$、$NaHCO_{3}$与足量盐酸反应,前者比后者剧烈,且产生的气体也更多
C.将一小块钠投入$FeCl_{3}$溶液中,既有气体产生又有白色沉淀生成
D.将$Na_{2}CO_{3}和NaHCO_{3}$混合物充分加热,质量由$ag减为bg$,由$a$、$b可求Na_{2}CO_{3}$的质量
D
)A.钠与熔融$TiCl_{4}$反应冶炼钛,其中钠被还原,具有还原性
B.等质量的$Na_{2}CO_{3}$、$NaHCO_{3}$与足量盐酸反应,前者比后者剧烈,且产生的气体也更多
C.将一小块钠投入$FeCl_{3}$溶液中,既有气体产生又有白色沉淀生成
D.将$Na_{2}CO_{3}和NaHCO_{3}$混合物充分加热,质量由$ag减为bg$,由$a$、$b可求Na_{2}CO_{3}$的质量
答案:
D [A. 钠与熔融 $\text{TiCl}_{4}$ 反应得到氯化钠和钛, 其中钠元素化合价升高、被氧化, 钠具有还原性, A错误; B. 碳酸钠和碳酸氢钠分别与足量盐酸作用, 碳酸氢钠和盐酸反应生成二氧化碳, 碳酸钠和盐酸反应先生成碳酸氢钠后再和盐酸反应生成二氧化碳, 所以碳酸氢钠比碳酸钠更剧烈, $106 \mathrm{~g}$ $\mathrm{Na}_{2} \mathrm{CO}_{3}$ 与足量盐酸反应放出 $44 \mathrm{~g}$ 二氧化碳, $84 \mathrm{~g} \mathrm{NaHCO}_{3}$ 与足量盐酸反应放出 $44 \mathrm{~g}$ 二氧化碳, 等质量的 $\mathrm{Na}_{2} \mathrm{CO}_{3} 、 \mathrm{NaHCO}_{3}$ 与足量盐酸反应, 后者产生的 $\mathrm{CO}_{2}$ 更多, B 错误; C. 将一小块钠投入 $\mathrm{FeCl}_{3}$ 溶液中, 钠先和水反应生成氢氧化钠和氢气, 氢氧化钠再和氯化铁反应生成氢氧化铁和氯化钠, 故既有气体产生又有红褐色沉淀生成, C 错误; D. 取 $a \mathrm{~g} \mathrm{Na}_{2} \mathrm{CO}_{3}$ 和 $\mathrm{NaHCO}_{3}$ 的固体混合物充分加热, 质量减为 $b \mathrm{~g}$, 减少的质量为 $\mathrm{NaHCO}_{3}$ 分解产生的 $\mathrm{H}_{2} \mathrm{O} 、 \mathrm{CO}_{2}$ 的质量, 根据物质反应方程式中转化关系, 可得分解的 $\mathrm{NaHCO}_{3}$ 的质量, 进而可测定出 $\mathrm{Na}_{2} \mathrm{CO}_{3}$ 的质量, D 正确;故选 D。]
2.(2025·江西·期中)下列关于$Na_{2}O和Na_{2}O_{2}$的叙述不正确的是 (
A.等质量的$Na_{2}O_{2}分别与足量H_{2}O$、$CO_{2}$反应,转移的电子数相同
B.$Na_{2}O_{2}分别与H_{2}O$、$CO_{2}$、稀硫酸的反应中,$Na_{2}O_{2}$都是既作氧化剂又作还原剂
C.$Na_{2}O和Na_{2}O_{2}$中的阴、阳离子个数之比均为$1:2$
D.$Na_{2}O和Na_{2}O_{2}$都能与酸反应生成盐和水,所以都是碱性氧化物
D
)A.等质量的$Na_{2}O_{2}分别与足量H_{2}O$、$CO_{2}$反应,转移的电子数相同
B.$Na_{2}O_{2}分别与H_{2}O$、$CO_{2}$、稀硫酸的反应中,$Na_{2}O_{2}$都是既作氧化剂又作还原剂
C.$Na_{2}O和Na_{2}O_{2}$中的阴、阳离子个数之比均为$1:2$
D.$Na_{2}O和Na_{2}O_{2}$都能与酸反应生成盐和水,所以都是碱性氧化物
答案:
D [A. $\mathrm{Na}_{2} \mathrm{O}_{2}$ 分别与足量 $\mathrm{H}_{2} \mathrm{O} 、 \mathrm{CO}_{2}$ 反应的化学方程式分别为: $2 \mathrm{Na}_{2} \mathrm{O}_{2}+2 \mathrm{H}_{2} \mathrm{O}=4 \mathrm{NaOH}+$ $\mathrm{O}_{2} \uparrow 、 2 \mathrm{Na}_{2} \mathrm{O}_{2}+2 \mathrm{CO}_{2}=2 \mathrm{Na}_{2} \mathrm{CO}_{3}+\mathrm{O}_{2}$, 根据反应方程式可知: 每 $2 \mathrm{~mol} \mathrm{Na}_{2} \mathrm{O}_{2}$ 发生上述 2 个反应, 转移电子的物质的量都是 $2 \mathrm{~mol}$, 则等质量的 $\mathrm{Na}_{2} \mathrm{O}_{2}$ 分别与足量 $\mathrm{H}_{2} \mathrm{O} 、 \mathrm{CO}_{2}$ 反应, 转移的电子数相同, A 正确; B. $\mathrm{Na}_{2} \mathrm{O}_{2}$ 分别与足量 $\mathrm{H}_{2} \mathrm{O} 、 \mathrm{CO}_{2}$反应的化学方程式分别为: $2 \mathrm{Na}_{2} \mathrm{O}_{2}+2 \mathrm{H}_{2} \mathrm{O}=$ $4 \mathrm{NaOH}+\mathrm{O}_{2} \uparrow 、 2 \mathrm{Na}_{2} \mathrm{O}_{2}+2 \mathrm{CO}_{2}=2 \mathrm{Na}_{2} \mathrm{CO}_{3}+$ $\mathrm{O}_{2}$, 其与稀硫酸反应的化学方程式为: $2 \mathrm{Na}_{2} \mathrm{O}_{2}+$ $2 \mathrm{H}_{2} \mathrm{SO}_{4}=2 \mathrm{Na}_{2} \mathrm{SO}_{4}+2 \mathrm{H}_{2} \mathrm{O}+\mathrm{O}_{2} \uparrow$, 在上述三个反应中都是 $\mathrm{Na}_{2} \mathrm{O}_{2}$ 中 -1 价的 $\mathrm{O}$ 部分升高变为 $\mathrm{O}_{2}$ 的 0 价, 部分降低变为化合物中的 -2 价,因此 $\mathrm{Na}_{2} \mathrm{O}_{2}$ 都是既作氧化剂又作还原剂, B 正确; C. $\mathrm{Na}_{2} \mathrm{O}$ 是离子化合物, 由 2 个 $\mathrm{Na}^{+}$和 1 个 $\mathrm{O}^{2-}$ 构成, 阴、阳离子个数之比为 $1: 2 ; \mathrm{Na}_{2} \mathrm{O}_{2}$ 是离子化合物, 由 2 个 $\mathrm{Na}^{+}$和 1 个 $\mathrm{O}_{2}^{2-}$ 构成, 阴、阳离子个数之比也为 $1: 2$, C 正确; D. $\mathrm{Na}_{2} \mathrm{O}$ 能与酸反应生成盐和水, 所以 $\mathrm{Na}_{2} \mathrm{O}$ 属于碱性氧化物;但 $\mathrm{Na}_{2} \mathrm{O}_{2}$ 与酸反应除生成盐和水, 同时还反应产生 $\mathrm{O}_{2}$, 反应过程中元素化合价发生了改变, 所以 $\mathrm{Na}_{2} \mathrm{O}_{2}$ 不属于碱性氧化物, D 错误; 故选 D。]
3.(2025·江苏南通·期中)某种天然碱的化学式为$aNa_{2}CO_{3}\cdot bNaHCO_{3}\cdot cH_{2}O$,取一定质量该天然碱溶于水,逐滴加入稀盐酸,溶液中的$NaHCO_{3}的物质的量与加入HCl$的物质的量关系如图所示。下列说法不正确的是 (

A.$a:b= 1:2$
B.P点处溶液中$c(Na^{+}):c(Cl^{-})= 2:1$
C.若Q点时溶液体积为5L,溶液中的$Na^{+}浓度为0.8mol\cdot L^{-1}$
D.将该天然碱溶液和一定量盐酸混合,发生反应的离子方程式不可能是:$2CO_{3}^{2-}+3HCO_{3}^{-}+7H^{+}= 5CO_{2}\uparrow +5H_{2}O$
D
)
A.$a:b= 1:2$
B.P点处溶液中$c(Na^{+}):c(Cl^{-})= 2:1$
C.若Q点时溶液体积为5L,溶液中的$Na^{+}浓度为0.8mol\cdot L^{-1}$
D.将该天然碱溶液和一定量盐酸混合,发生反应的离子方程式不可能是:$2CO_{3}^{2-}+3HCO_{3}^{-}+7H^{+}= 5CO_{2}\uparrow +5H_{2}O$
答案:
D [根据图像可知, 加入盐酸, $\mathrm{NaHCO}_{3}$ 的物质的量先增大, 说明 $\mathrm{MN}$ 段发生反应: $\mathrm{CO}_{3}^{2-}+$ $\mathrm{H}^{+}=\mathrm{HCO}_{3}^{-}$; 继续加入盐酸, $\mathrm{NaHCO}_{3}$ 的物质的量减小, 说明 $\mathrm{NQ}$ 段发生反应: $\mathrm{HCO}_{3}^{-}+\mathrm{H}^{+}=$ $\mathrm{H}_{2} \mathrm{O}+\mathrm{CO}_{2} \uparrow$ 。A. $\mathrm{MN}$ 段发生反应: $\mathrm{CO}_{3}^{2-}+\mathrm{H}^{+}=$ $\mathrm{HCO}_{3}^{-}$, 消耗 $\mathrm{HCl} 1 \mathrm{~mol}$, 说明含 $n\left(\mathrm{Na}_{2} \mathrm{CO}_{3}\right)=1 \mathrm{~mol}$,同时生成 $1 \mathrm{~mol} \mathrm{NaHCO}_{3}, \mathrm{NQ}$ 段发生反应: $\mathrm{HCO}_{3}^{-}+$ $\mathrm{H}^{+}=\mathrm{H}_{2} \mathrm{O}+\mathrm{CO}_{2} \uparrow$, 消耗 $\mathrm{HCl} 3 \mathrm{~mol}$, 消耗 $3 \mathrm{~mol}$ $\mathrm{NaHCO}_{3}$, 其中 $1 \mathrm{~mol} \mathrm{NaHCO}_{3}$ 为 $\mathrm{MN}$ 段反应生成, 说明原本含 $2 \mathrm{~mol} \mathrm{NaHCO}_{3}$, 则 $a: b=1: 2$, A正确; B. 根据 A 项计算可知, 样品中 $\mathrm{NaHCO}_{3}$ 物质的量为 $2 \mathrm{~mol}$, 当加入 $\mathrm{HCl}$ 为 $1 \mathrm{~mol}$ 时, $\mathrm{NaHCO}_{3}$ 物质的量为 $3 \mathrm{~mol}$, 同时生成氯化钠 $1 \mathrm{~mol}$, 当加入 $\mathrm{HCl}$ 为 $2 \mathrm{~mol}$ 时, $\mathrm{NaHCO}_{3}$ 物质的量为 $2 \mathrm{~mol}$, 生成的氯化钠共 $2 \mathrm{~mol}$, 即 $\mathrm{P}$ 点处溶液中 $c\left(\mathrm{Na}^{+}\right): c\left(\mathrm{Cl}^{-}\right)=2: 1$, B 正确; C. 根据 B项分析可知, 溶液中钠离子总量为 $4 \mathrm{~mol}$, 则当溶液体积为 $5 \mathrm{~L}$ 时, 溶液中 $\mathrm{Na}^{+}$浓度为 $0.8 \mathrm{~mol} \cdot \mathrm{L}^{-1}$, C 正确; D. 天然碱含 $1 \mathrm{~mol} \mathrm{Na}_{2} \mathrm{CO}_{3} 、 2 \mathrm{~mol} \mathrm{NaHCO}_{3}$,当 $\mathrm{Na}_{2} \mathrm{CO}_{3} 、 \mathrm{NaHCO}_{3}$ 按物质的量之比为 $1: 1.5$ 反应时, 离子方程式: $2 \mathrm{CO}_{3}^{2-}+3 \mathrm{HCO}_{3}^{-}+7 \mathrm{H}^{+}=$ $5 \mathrm{CO}_{2} \uparrow+5 \mathrm{H}_{2} \mathrm{O}$, D 错误; 故选 D。]
4.(2025·四川成都·期中)部分常见含氯物质的分类与相应化合价关系如图所示,下列推断不合理的是 (
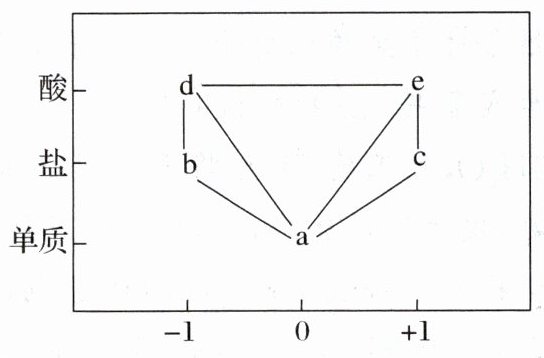
A.a可以作氧化剂,也可以作还原剂
B.d的浓溶液与c的固体反应一定生成b与e
C.实验室可通过加热$MnO_{2}$与d的浓溶液制得a
D.可存在$a→c→e→d→b→a$的循环转化关系
B
)
A.a可以作氧化剂,也可以作还原剂
B.d的浓溶液与c的固体反应一定生成b与e
C.实验室可通过加热$MnO_{2}$与d的浓溶液制得a
D.可存在$a→c→e→d→b→a$的循环转化关系
答案:
B [由图可知, $a$ 为氯气、 $b$ 为金属氯化物、 $c$ 为次氯酸盐、 $d$ 为盐酸、 $e$ 为次氯酸。A. 氯气中氯元素的化合价为中间价态 0 价, 既能升高被氧化又能降低被还原, 所以氯气既可作氧化剂, 也可作还原剂, A 正确; B. 浓盐酸与次氯酸盐反应生成金属氯化物、氯气和水, 不能生成次氯酸, B 错误; C. 实验室用二氧化锰与浓盐酸共热反应制备氯气, 反应的化学方程式为 $\mathrm{MnO}_{2}+4 \mathrm{HCl}$ (浓) $\stackrel{\triangle}{=} \mathrm{MnCl}_{2}+\mathrm{Cl}_{2} \uparrow+$ $2 \mathrm{H}_{2} \mathrm{O}$, C 正确; D. 由性质可知, 氯元素及其化合物存在如下转化关系: $\mathrm{Cl}_{2} \stackrel{\mathrm{OH}^{-}}{\to} \mathrm{ClO}^{-} \stackrel{\mathrm{H}^{+}}{\to} \mathrm{HClO} \stackrel{\text { 光照 }}{\to}$ $\mathrm{HCl} \stackrel{\mathrm{OH}^{-}}{\to} \mathrm{Cl}^{-} \stackrel{\text { 酸性 } \mathrm{KMnO}_{4} \text { 溶液 }}{\to} \mathrm{Cl}_{2}$, D 正确; 故选 B。]
查看更多完整答案,请扫码查看


