2025年赢在高考假期作业必刷题高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年赢在高考假期作业必刷题高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
5.(2025·云南曲靖·期末)为探究新制氯水的性质,某学生进行了如下表所示的实验:
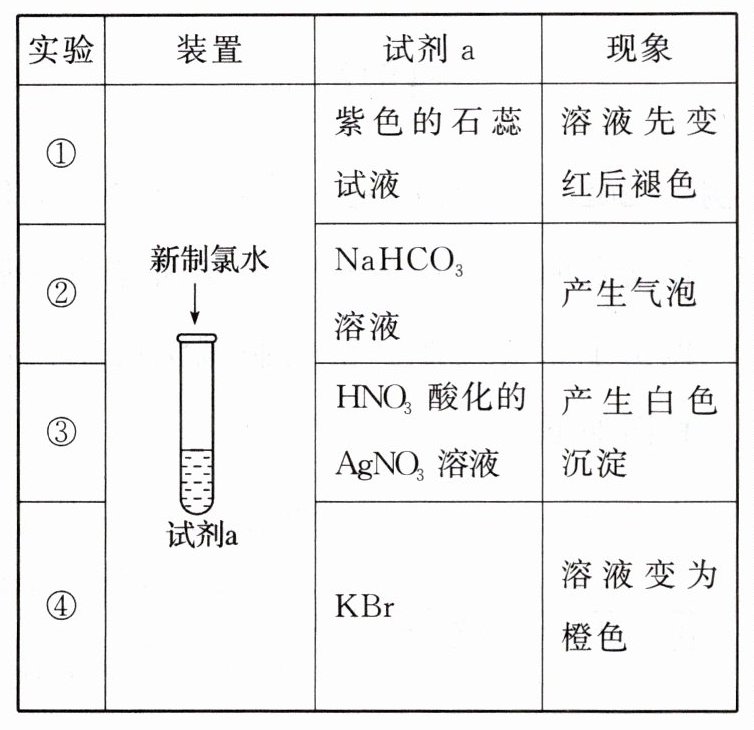
由上述实验可得新制氯水的性质与对应的解释或离子方程式不相符的是 (
A.实验①说明新制氯水中含有$H^{+}$、$HClO$
B.实验②发生反应的离子方程式为$HCO_{3}^{-}+HClO= Cl^{-}+CO_{2}\uparrow +H_{2}O$
C.实验③说明新制氯水中有$Cl^{-}:Cl^{-}+Ag^{+}= AgCl\downarrow $
D.实验④体现氯气的氧化性:$2Br^{-}+Cl_{2}= Br_{2}+2Cl^{-}$

由上述实验可得新制氯水的性质与对应的解释或离子方程式不相符的是 (
B
)A.实验①说明新制氯水中含有$H^{+}$、$HClO$
B.实验②发生反应的离子方程式为$HCO_{3}^{-}+HClO= Cl^{-}+CO_{2}\uparrow +H_{2}O$
C.实验③说明新制氯水中有$Cl^{-}:Cl^{-}+Ag^{+}= AgCl\downarrow $
D.实验④体现氯气的氧化性:$2Br^{-}+Cl_{2}= Br_{2}+2Cl^{-}$
答案:
B [A. 实验①溶液先变红, 说明呈酸性, 后褪色说明有漂白性物质, 说明新制氯水中含有 $\mathrm{H}^{+}$、 $\mathrm{HClO}, \mathrm{A}$ 正确; B. 次氯酸与碳酸氢钠不反应, 产生气泡是盐酸跟碳酸氢钠反应, 实验②发生反应的离子方程式为 $\mathrm{HCO}_{3}^{-}+\mathrm{H}^{+}=\mathrm{CO}_{2} \uparrow+\mathrm{H}_{2} \mathrm{O}$, B 错误; C. 实验③白色沉淀是氯化银, 说明新制氯水中有 $\mathrm{Cl}^{-}: \mathrm{Cl}^{-}+\mathrm{Ag}^{+}=\mathrm{AgCl} \downarrow$, C 正确;D. 实验④溶液变为橙色, 说明产生了溴单质, 即氯气与溴离子反应生成溴单质, 体现氯气的氧化性: $2 \mathrm{Br}^{-}+\mathrm{Cl}_{2}=\mathrm{Br}_{2}+2 \mathrm{Cl}^{-}$, D 正确; 故选 B。]
6.(2025·山东青岛·期末)设计如下实验制备、收集纯净干燥的氯气,并探究其性质,其中b为湿润的蓝色石蕊试纸。下列说法错误的是 (
A.a导管可达到平衡气压便于浓盐酸顺利流下的目的
B.该装置中存在两处错误
C.甲中为浓硫酸、乙中为饱和食盐水
D.装置错误改正后进行实验,b先变红,一段时间后褪色
C
)A.a导管可达到平衡气压便于浓盐酸顺利流下的目的
B.该装置中存在两处错误
C.甲中为浓硫酸、乙中为饱和食盐水
D.装置错误改正后进行实验,b先变红,一段时间后褪色
答案:
C $\left[\mathrm{MnO}_{2}\right.$ 与浓盐酸混合加热制取 $\mathrm{Cl}_{2}$, 导气管 a将分液漏斗上下联通, 其作用可以使盐酸顺利滴下。由于浓盐酸具有挥发性, 所以制取的氯气中含有杂质 $\mathrm{HCl}$ 和水蒸气, 先通过甲的饱和食盐水除去杂质 $\mathrm{HCl}$, 然后通过装置乙的浓硫酸干燥 $\mathrm{Cl}_{2}$, 再根据氯气密度比空气大的性质, 用向上排空气方法收集 $\mathrm{Cl}_{2}$, 导气管应该长进短出。将 $\mathrm{Cl}_{2}$通入装置丁的湿润的紫色石蕊试纸, 看到试纸先变红后褪色, 说明氯气与水反应产生了 $\mathrm{HCl}$ 、 $\mathrm{HClO}$, 装置戊中 $\mathrm{NaOH}$ 溶液的作用是尾气处理,该装置应该是敞口容器, 而不能密封。A. a 导管可平衡气压, 便于浓盐酸顺利流下, A 正确; B. 装置丙用于收集 $\mathrm{Cl}_{2}$, 由于 $\mathrm{Cl}_{2}$ 的密度比空气大, 因此导气管应为长进短出, 装置戊是尾气处理装置, 不能是密封装置, 故有两处错误, B 正确;C. 使用 $\mathrm{MnO}_{2}$ 与浓盐酸混合加热制取的 $\mathrm{Cl}_{2}$ 中含有杂质 $\mathrm{HCl}$ 及水蒸气, 应该先除去氯气中的杂质 $\mathrm{HCl}$, 然后再除去水蒸气, 装置甲应先除去氯气中氯化氢, 再除去水, 甲中为饱和食盐水, 乙为浓硫酸, C 错误; D. 氯气溶于水生成盐酸和次氯酸, 盐酸使紫色石蕊试液变为红色, 次氯酸具有强氧化性, 会将红色物质氧化变为无色, 故湿润的蓝色石蕊试纸先变红, 一段时间后褪色, D 正确; 故选 C。]
(2023·广东卷)部分含Na或含Cu物质的分类与相应化合价关系如图所示。下列推断不合理的是 (
A.可存在$c→d→e$的转化
B.能与$H_{2}O$反应生成c的物质只有b
C.新制的d可用于检验葡萄糖中的醛基
D.若b能与$H_{2}O反应生成O_{2}$,则b中含共价键
B
)A.可存在$c→d→e$的转化
B.能与$H_{2}O$反应生成c的物质只有b
C.新制的d可用于检验葡萄糖中的醛基
D.若b能与$H_{2}O反应生成O_{2}$,则b中含共价键
答案:
B [由图可知 $a 、 b 、 c$ 对应物质分别为: 钠、氧化钠 (过氧化钠)、氢氧化钠或 $a 、 b 、 e 、 d$ 对应物质分别为: 铜、氧化亚铜、氧化铜、氢氧化铜。A. 由分析可知氢氧化钠和硫酸铜反应生成氢氧化铜, 氢氧化铜受热分解生成氧化铜, 所以存在 $c \to d \to e$的转化, A 合理; B. 钠和氧化钠 (过氧化钠) 都能与 $\mathrm{H}_{2} \mathrm{O}$ 反应生成氢氧化钠, B 不合理; C. 新制氢氧化铜可用于检验葡萄糖中的醛基, C 合理;D. 若 $b$ 能与 $\mathrm{H}_{2} \mathrm{O}$ 反应生成 $\mathrm{O}_{2}$, 则 $b$ 为过氧化钠, 结构中含共价键和离子键, D 合理; 故选 B。]
(1)仪器a的名称为
(2)B中所装试剂名称为
(3)实验开始时,通入一段时间氮气的目的是
(4)A、B装置中的空气可以通过控制活塞$K_{2}$、$K_{3}$来去除,具体方法为
(5)A中发生反应的离子方程式为
(6)实验制得的粗产品中常含有少量$POCl_{3}和PCl_{5}$。加入红磷加热可去除$PCl_{5}$,发生的反应化学方程式为
分液漏斗
。(2)B中所装试剂名称为
浓硫酸
。(3)实验开始时,通入一段时间氮气的目的是
排出装置 D 中的空气,防止 P、PCl₃ 与氧气反应,同时避免 PCl₃ 与水蒸气反应
。(4)A、B装置中的空气可以通过控制活塞$K_{2}$、$K_{3}$来去除,具体方法为
关闭 K₂、打开 K₃,打开分液漏斗塞子和活塞,当看到 B 装置中液面上方充满黄绿色气体时,打开 K₂、关闭 K₃
。(5)A中发生反应的离子方程式为
MnO₂ + 4H⁺ + 2Cl⁻ $\xlongequal{\triangle}$ Mn²⁺ + Cl₂↑ + 2H₂O
。(6)实验制得的粗产品中常含有少量$POCl_{3}和PCl_{5}$。加入红磷加热可去除$PCl_{5}$,发生的反应化学方程式为
3PCl₅ + 2P $\xlongequal{\triangle}$ 5PCl₃
,然后通过蒸馏
(填实验操作名称),即可得到较纯净的$PCl_{3}$。
答案:
(1) 分液漏斗
(2) 浓硫酸
(3) 排出装置 D 中的空气,防止 P、PCl₃ 与氧气反应,同时避免 PCl₃ 与水蒸气反应
(4) 关闭 K₂、打开 K₃,打开分液漏斗塞子和活塞,当看到 B 装置中液面上方充满黄绿色气体时,打开 K₂、关闭 K₃
(5) MnO₂ + 4H⁺ + 2Cl⁻ $\xlongequal{\triangle}$ Mn²⁺ + Cl₂↑ + 2H₂O
(6) 3PCl₅ + 2P $\xlongequal{\triangle}$ 5PCl₃;蒸馏
(1) 分液漏斗
(2) 浓硫酸
(3) 排出装置 D 中的空气,防止 P、PCl₃ 与氧气反应,同时避免 PCl₃ 与水蒸气反应
(4) 关闭 K₂、打开 K₃,打开分液漏斗塞子和活塞,当看到 B 装置中液面上方充满黄绿色气体时,打开 K₂、关闭 K₃
(5) MnO₂ + 4H⁺ + 2Cl⁻ $\xlongequal{\triangle}$ Mn²⁺ + Cl₂↑ + 2H₂O
(6) 3PCl₅ + 2P $\xlongequal{\triangle}$ 5PCl₃;蒸馏
查看更多完整答案,请扫码查看


