2025年赢在高考假期作业必刷题高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年赢在高考假期作业必刷题高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
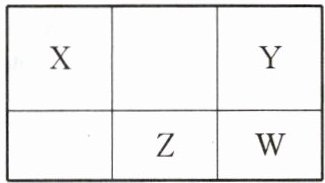
5. 四种短周期元素在周期表中的位置如下表所示,其中W元素原子的M层电子数是K层电子数的3倍,下列说法不正确的是(
A.非金属性:${W>Z}$
B.原子半径:${Z>Y}$
C.元素X、Y的简单氢化物沸点:${X<Y}$
D.元素Z的最高价氧化物对应的水化物是强酸
D
)
A.非金属性:${W>Z}$
B.原子半径:${Z>Y}$
C.元素X、Y的简单氢化物沸点:${X<Y}$
D.元素Z的最高价氧化物对应的水化物是强酸
答案:
D [短周期元素W元素原子的M层电子数是K层电子数的3倍,则W原子核外电子排布是2、8、6,所以W是S,根据元素在周期表的相对位置,可知Y是O,X是C,Z是P,然后根据元素周期律及物质的性质分析解答。A. 根据上述分析可知:Z是P,W是S,这两种元素位于元素周期表同一周期,原子序数越大,元素的非金属性就越强,原子序数:${W(S)}>{Z(P)}$,所以元素的非金属性:${W(S)}>{Z(P)}$,A正确;B. 根据上述分析可知:Y是O,Z是P,原子核外电子层数越多,原子半径就越大,O原子核外有2个电子层,P原子核外有3个电子层,所以原子半径:${P}>{O}$,B正确;C. 根据上述分析可知:X是C,Y是O,它们形成的简单氢化物分别是${CH_{4}}$、${H_{2}O}$,在常温下${CH_{4}}$是气体,${H_{2}O}$是液体,因此物质的沸点:${CH_{4}}<{H_{2}O}$,C正确;D. 根据上述分析可知:Z是P,其最高价氧化物对应的水化物${H_{3}PO_{4}}$是中强酸,属于弱酸,D错误;故选D。]
6. 一种麻醉剂的结构式如下图所示。元素X的原子核只有1个质子,元素Y、Z、W的原子序数依次增大。且均位于X的下一周期,元素E的原子比元素W的原子多8个电子。下列说法错误的是(
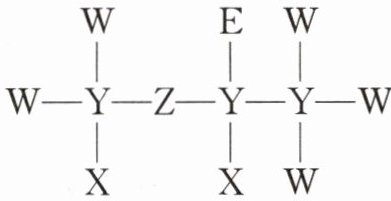
A.${XEZ_{4}}$是一种强酸
B.离子半径:${E>W>Z}$
C.非金属性:${Y<Z<W}$
D.${ZW_{2}}$中,Z的化合价为+2价
B
) 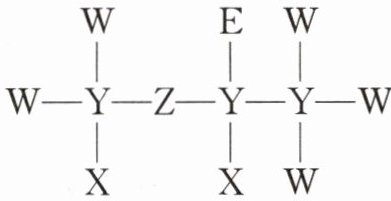
A.${XEZ_{4}}$是一种强酸
B.离子半径:${E>W>Z}$
C.非金属性:${Y<Z<W}$
D.${ZW_{2}}$中,Z的化合价为+2价
答案:
B [由题干信息可知,X的原子核只有1个质子,则X为H元素;元素Y、Z、W原子序数依次增大,且均位于X(氢)的下一周期,分子结构中Y形成4条共价键、Z形成2条共价键、W形成1条共价键,推知Y为C元素、Z为O元素、W为F元素;元素E的原子比W(氟)原子多8个电子,故E的质子数为$9 + 8 = 17$,则E为Cl元素。即X为H、Y为C、Z为O、W为F、E为Cl。A. ${XEZ_{4}}$为${HClO_{4}}$,是一种强酸,A正确;B. 电子层结构相同的离子,核电荷数越大,离子半径越小,离子的电子层越多,离子半径越大,故离子半径${Cl^{-}}>{O^{2-}}>{F^{-}}$即$E>Z>W$,B错误;C. 同周期从左到右元素的非金属性逐渐增强,非金属性:${C}<{O}<{F}$,C正确;D. W为F、Z为O,且O的非金属性弱于F,${OF_{2}}$中O的化合价为$+2$价,D正确;故选B。]
7. 短周期主族元素X、Y、Z、M、Q的原子序数依次增大,Y在短周期中原子半径最大,Z是地壳中含量最高的金属元素,X和M同主族,M的最高正化合价与最低负化合价的代数和为4,下列说法不正确的是(
A.简单气态氢化物的稳定性:${M>Q}$
B.原子半径由小到大的顺序:${{r}(X)<{r}(M)<{r}(Z)}$
C.Y、Z、M三种元素最高价氧化物对应水化物两两之间均可发生反应
D.X与Y元素形成的两种氧化物中阴阳离子个数比均为$1:2$
A
)A.简单气态氢化物的稳定性:${M>Q}$
B.原子半径由小到大的顺序:${{r}(X)<{r}(M)<{r}(Z)}$
C.Y、Z、M三种元素最高价氧化物对应水化物两两之间均可发生反应
D.X与Y元素形成的两种氧化物中阴阳离子个数比均为$1:2$
答案:
A [短周期主族元素X、Y、Z、M、Q的原子序数依次增大,Y在短周期中原子半径最大,Y是Na元素;Z是地壳中含量最高的金属元素,Z是Al元素;X和M同主族,M的最高正化合价与最低负化合价的代数和为4,M是S元素、X是O元素,则Q是Cl元素。A. 同周期元素从左到右,非金属性增强,气态氢化物稳定性增强,简单气态氢化物的稳定性${H_{2}S}<{HCl}$,A错误;B. 电子层数越多半径越大,电子层数相同,质子数越多半径越小,原子半径由小到大的顺序:$r(O)<r(S)<r(Al)$,B正确;C. ${Al(OH)_{3}}$是两性氢氧化物,${NaOH}$、${Al(OH)_{3}}$、${H_{2}SO_{4}}$两两之间均可发生反应,C正确;D. O与Na元素形成的${Na_{2}O}$、${Na_{2}O_{2}}$两种氧化物中阴阳离子个数比均为$1:2$,D正确;故选A。]
8. 随着元素周期表的建立和元素周期律的发现,人们从微观角度探索元素之间的内在联系,认识化学反应的本质。下列推测不合理的是(
A.若${X^{+}}和{Y^{2-}}$的核外电子层结构相同,则原子序数:${X>Y}$
B.Si与${H_{2}}$高温时反应,S与${H_{2}}$加热能反应,则P与${H_{2}}$在高温时能反应
C.由元素的非金属性:${F>Cl}$,可推断水溶液的酸性:${HF>HCl}$
D.Mg、Ca、Sr、Ba均为ⅡA族元素,${MgSO_{4}}$易溶于水,${CaSO_{4}}$微溶于水,则${SrSO_{4}}$可能难溶于水
C
)A.若${X^{+}}和{Y^{2-}}$的核外电子层结构相同,则原子序数:${X>Y}$
B.Si与${H_{2}}$高温时反应,S与${H_{2}}$加热能反应,则P与${H_{2}}$在高温时能反应
C.由元素的非金属性:${F>Cl}$,可推断水溶液的酸性:${HF>HCl}$
D.Mg、Ca、Sr、Ba均为ⅡA族元素,${MgSO_{4}}$易溶于水,${CaSO_{4}}$微溶于水,则${SrSO_{4}}$可能难溶于水
答案:
C [A. X失去1个电子得到${X^{+}}$,Y原子得到2个电子生成${Y^{2-}}$,若${X^{+}}$和${Y^{2-}}$的核外电子层结构相同,则原子序数:$X>Y$,A正确;B. 同周期元素从左到右非金属性增强,元素非金属性越强越易与氢气反应,Si与${H_{2}}$高温时反应,S与${H_{2}}$加热能反应,则P与${H_{2}}$在高温时能反应,B正确;C. 无氧酸的酸性与元素非金属性没有直接关系,HF是弱酸、HCl是强酸,C错误;D. Mg、Ca、Sr、Ba均为ⅡA族元素,${MgSO_{4}}$易溶于水,${CaSO_{4}}$微溶于水,同主族元素从上到下,硫酸盐的溶解度减小,则${SrSO_{4}}$可能难溶于水,D正确;故选C。]
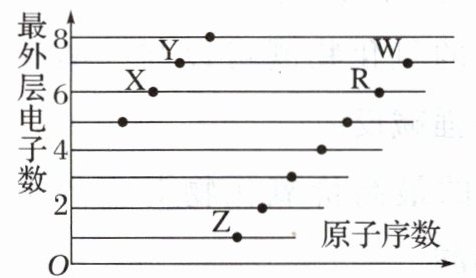
9. 如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图,则下列说法正确的是(
A.单质X与Z的反应产物中,阴阳离子个数比为$1:2$
B.Z的单质很活泼,能将铜从其盐溶液中置换出来
C.X与R的氢化物稳定性:${H_{2}X<H_{2}R}$
D.W的单质有毒,不能用于自来水的消毒
A
)
A.单质X与Z的反应产物中,阴阳离子个数比为$1:2$
B.Z的单质很活泼,能将铜从其盐溶液中置换出来
C.X与R的氢化物稳定性:${H_{2}X<H_{2}R}$
D.W的单质有毒,不能用于自来水的消毒
答案:
A [如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图,X、Y位于第二周期,Z、R、W位于第三周期,根据各原子最外层电子数可知,X为O,Y为F,Z为Na,R为S,W为Cl元素,以此分析解答。A. 由分析可知,X为O,Z为Na,故单质X与Z的反应生可以成两种氧化物${Na_{2}O}$和${Na_{2}O_{2}}$,二者的阴阳离子个数比均为$1:2$,A正确;B. 由分析可知,Z为Na,Z的单质很活泼,但不能将铜从其盐溶液中置换出来,由于Na先与水反应,生成的${NaOH}$再与${Cu^{2+}}$反应生成${Cu(OH)_{2}}$,B错误;C. X与R的氢化物分别是${H_{2}O}$和${H_{2}S}$,二者的稳定性:${H_{2}O}>{H_{2}S}$,C错误;D. 氯气有毒,${Cl_{2}}$与${H_{2}O}$反应生成的HClO具有强氧化性,可以用于自来水的消毒,D错误;故选A。]
查看更多完整答案,请扫码查看


