第8页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
19. 我国科学家利用$CO{}_{2}$合成淀粉的核心反应如图所示,设$N{}_{A}$为阿伏加德罗常数的值。下列说法正确的是(
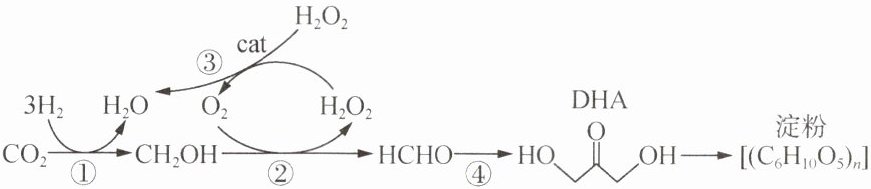
A.反应①消耗$4.4gCO{}_{2}$时,转移电子数为$0.6N{}_{A}$
B.标准状况下$11.2LH{}_{2}O{}_{2}所含的非极性键键数为N{}_{A}$
C.$30gHCHO与DHA的混合物中含氧原子数为2N{}_{A}$
D.$16.2g淀粉在酶的作用下发酵酿酒最多可生成乙醇分子数为0.3N{}_{A}$
A
)
A.反应①消耗$4.4gCO{}_{2}$时,转移电子数为$0.6N{}_{A}$
B.标准状况下$11.2LH{}_{2}O{}_{2}所含的非极性键键数为N{}_{A}$
C.$30gHCHO与DHA的混合物中含氧原子数为2N{}_{A}$
D.$16.2g淀粉在酶的作用下发酵酿酒最多可生成乙醇分子数为0.3N{}_{A}$
答案:
19.A 解析:A.由反应机理可知,反应①发生的反应为二氧化碳与氢气反应生成甲醇和氢气,则消耗4.4g二氧化碳,反应转移电子数为$\frac{4.4g}{44g/mol}×6×N_{A}mol^{-1} = 0.6N_{A}$,故A正确;B.标准状况下,过氧化氢为液态,无法计算11.2L过氧化氢的物质的量和含有的非极性键的数目,故B错误;C.甲醛和DHA的最简式相同,都为$CH_{2}O$,则30g甲醛与DHA的混合物中含氧原子数为$\frac{30g}{30g/mol}×N_{A}mol^{-1} = N_{A}$,故C 错误;D.由淀粉酿酒涉及的反应可得如下关系式:$(C_{6}H_{10}O_{5})_{n} \sim nC_{6}H_{12}O_{6} \sim 2nC_{2}H_{5}O_{2}$,则16.2g淀粉在酶的作用下发酵酿酒最多可生成乙醇分子数为$\frac{16.2g}{162n g/mol}×2n×N_{A}mol^{-1} = 0.2N_{A}$,故D错误。
20. $N{}_{A}$表示阿伏加德罗常数,下列说法正确的是(
A.标准状况下,等体积的水和$CO{}_{2}$,含有的氧原子数目为$1\colon 2$
B.含有$N{}_{A}个阴离子的Na{}_{2}O{}_{2}$与足量水反应,转移电子数为$2N{}_{A}$
C.向$FeI{}_{2}$溶液中通入适量氯气,当有$N{}_{A}个Fe{}^{2+}$被氧化时,共转移电子数为$3N{}_{A}$
D.一个$NO分子质量为ag$,一个$NO{}_{2}分子质量是bg$,则$N{}_{A}个O{}_{2}的质量为(b-a)N{}_{A}g$
C
)A.标准状况下,等体积的水和$CO{}_{2}$,含有的氧原子数目为$1\colon 2$
B.含有$N{}_{A}个阴离子的Na{}_{2}O{}_{2}$与足量水反应,转移电子数为$2N{}_{A}$
C.向$FeI{}_{2}$溶液中通入适量氯气,当有$N{}_{A}个Fe{}^{2+}$被氧化时,共转移电子数为$3N{}_{A}$
D.一个$NO分子质量为ag$,一个$NO{}_{2}分子质量是bg$,则$N{}_{A}个O{}_{2}的质量为(b-a)N{}_{A}g$
答案:
20.C 解析:A.标准状况下,水是液体,不能用气体摩尔体积计算,故A错误;B.含有$N_{A}$个阴离子的$Na_{2}O_{2}$为1mol,$Na_{2}O_{2}$与水的反应为歧化反应,1mol$Na_{2}O_{2}$转移1mol电子即$N_{A}$个,故B错误;C.向含有$FeI_{2}$的溶液中通入适量氯气,氯气先氧化$I^{-}$,当有1mol$Fe^{2+}$被氧化时转移$N_{A}$个电子;2mol$I^{-}$被氧化时转移2$N_{A}$个电子;该反应转移电子的数目至少为3$N_{A}$,故C正确;D.一个$NO_{2}$分子的质量为$a g$,一个$NO_{2}$分子质量为$b g$,1个氧原子的质量为$(b - a)g$,根据摩尔质量的概念:1mol物质具有的质量,所以1mol氧原子的质量:$N_{A}(b - a)$,$N_{A}$个$O_{2}$的质量为$2(b - a)N_{A}g$,故D错误。
21. 一定条件下,乙酸酐$[(CH{}_{3}CO){}_{2}O]醇解反应[(CH{}_{3}CO){}_{2}O+ROH\to CH{}_{3}COOR+CH{}_{3}COOH]$可进行完全,利用此反应定量测定有机醇$(ROH)$中的羟基含量,实验过程中酯的水解可忽略。实验步骤如下:
①配制一定浓度的乙酸酐—苯溶液。
②量取一定体积乙酸酐—苯溶液置于锥形瓶中,加入$mgROH$样品,充分反应后,加适量水使剩余乙酸酐完全水解:$(CH{}_{3}CO){}_{2}O+H{}_{2}O\to 2CH{}_{3}COOH$。
③加指示剂并用$cmol\cdot L{}^{-1}NaOH-$甲醇标准溶液滴定至终点,消耗标准溶液$V{}_{1}mL$。
④在相同条件下,量取相同体积的乙酸酐—苯溶液,只加适量水使乙酸酐完全水解;加指示剂并用$cmol\cdot L{}^{-1}NaOH-$甲醇标准溶液滴定至终点,消耗标准溶液$V{}_{2}mL$。$ROH$样品中羟基含量(质量分数)计算正确的是(
A.$\frac{c(V{}_{2}-V{}_{1})× 17}{1000m}× 100\%$
B.$\frac{c(V{}_{1}-V{}_{2})× 17}{1000m}× 100\%$
C.$\frac{0.5c(V{}_{2}-V{}_{1})× 17}{1000m}× 100\%$
D.$\frac{c(0.5V{}_{2}-V{}_{1})× 17}{1000m}× 100\%$
①配制一定浓度的乙酸酐—苯溶液。
②量取一定体积乙酸酐—苯溶液置于锥形瓶中,加入$mgROH$样品,充分反应后,加适量水使剩余乙酸酐完全水解:$(CH{}_{3}CO){}_{2}O+H{}_{2}O\to 2CH{}_{3}COOH$。
③加指示剂并用$cmol\cdot L{}^{-1}NaOH-$甲醇标准溶液滴定至终点,消耗标准溶液$V{}_{1}mL$。
④在相同条件下,量取相同体积的乙酸酐—苯溶液,只加适量水使乙酸酐完全水解;加指示剂并用$cmol\cdot L{}^{-1}NaOH-$甲醇标准溶液滴定至终点,消耗标准溶液$V{}_{2}mL$。$ROH$样品中羟基含量(质量分数)计算正确的是(
C
)A.$\frac{c(V{}_{2}-V{}_{1})× 17}{1000m}× 100\%$
B.$\frac{c(V{}_{1}-V{}_{2})× 17}{1000m}× 100\%$
C.$\frac{0.5c(V{}_{2}-V{}_{1})× 17}{1000m}× 100\%$
D.$\frac{c(0.5V{}_{2}-V{}_{1})× 17}{1000m}× 100\%$
答案:
21.C 解析:根据滴定过程中,用$c mol·L^{-1} NaOH - $ 甲醇标准溶液滴定乙酸酐完全水解生成的乙酸,消耗标准溶液$V_{2} mL$,需要消耗$c mol·L^{-1} NaOH - $ 甲醇的物质的量为$V_{2}×c×10^{-3} mol$,即乙酸酐的总物质的量$ = \frac{V_{2}×c×10^{-3}}{2} mol$;则$ROH$与乙酸酐反应后剩余的乙酸酐的物质的量$ = \frac{V_{1}×c×10^{-3}}{2} mol$,所以与$ROH$反应的乙酸酐的物质的量$ = \frac{V_{2}×c×10^{-3} - V_{1}×c×10^{-3}}{2} mol$,也即样品$ROH$中羟基的物质的量,所以$ROH$样品中羟基质量分数$ = \frac{\frac{V_{2}×c×10^{-3} - V_{1}×c×10^{-3}}{2} mol×17 g/mol}{m g}×100\% = \frac{0.5(V_{2} - V_{1})×c×17}{10^{3} m}×100\%$。
22. 设$N{}_{A}$为阿伏加德罗常数的值。下列说法正确的是(
A.$28.4gP{}_{2}O{}_{5}$( )含极性键的数目为$0.4N{}_{A}$
)含极性键的数目为$0.4N{}_{A}$
B.已知核反应:${}_{92}^{235}U+{}_{0}^{1}n\to {}_{56}^{144}Ba+{}_{A}^{Z}M+3{}_{0}^{1}n$,则$1mol{}^{Z}M中含中子数54N{}_{A}$
C.$0.25molZn$与一定量浓硫酸反应后完全溶解,生成气体的分子数等于$0.25N{}_{A}$
D.高温下,$5.6gFe$与足量水蒸气反应,转移的电子数为$0.3N{}_{A}$
C
)A.$28.4gP{}_{2}O{}_{5}$(
 )含极性键的数目为$0.4N{}_{A}$
)含极性键的数目为$0.4N{}_{A}$B.已知核反应:${}_{92}^{235}U+{}_{0}^{1}n\to {}_{56}^{144}Ba+{}_{A}^{Z}M+3{}_{0}^{1}n$,则$1mol{}^{Z}M中含中子数54N{}_{A}$
C.$0.25molZn$与一定量浓硫酸反应后完全溶解,生成气体的分子数等于$0.25N{}_{A}$
D.高温下,$5.6gFe$与足量水蒸气反应,转移的电子数为$0.3N{}_{A}$
答案:
22.C解析:A.28.4g$P_{2}O_{5}$为0.2mol,即0.1mol$P_{4}O_{10}$,1个$P_{4}O_{10}$含16个共价键(4个$P = O$,12个$P - O$,全部为极性键),则0.1mol$P_{4}O_{10}$含有共1.6mol共价键,也就是1.6$N_{A}$个,A错误;B.核反应方程式必须遵循核电荷数和质量数守恒,即可推算出$A = 36$,$Z = 89$,1mol$^{Z}M$中含中子$(89 - 36)N_{A} = 53N_{A}$,B错误;C.由得失电子数目守恒可知,1mol锌与稀硫酸反应生成1mol氢气,与浓硫酸反应生成1mol二氧化硫,则0.25mol$Zn$与一定量浓硫酸反应后完全溶解时,无论是生成氢气,还是二氧化硫,或是二氧化硫或氢气的混合气体,气体的分子数恒定为0.25mol×$N_{A}mol^{-1} = 0.25N_{A}$,C正确;D.高温下,$Fe$与足量水蒸气反应生成$Fe_{3}O_{4}$,5.6g$Fe$即0.1mol$Fe$转移电子数为$0.1×\frac{8}{3}N_{A} < 0.3N_{A}$,D 错误。
查看更多完整答案,请扫码查看


