第27页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
11. 一种甲烷催化氧化的反应历程如图所示,$*$表示吸附在催化剂表面。下列说法正确的是 (

A.适当提高${O_{2}}分压可以加快{O_{2}(g)\to 2^{*}O}$的反应速率
B.$^{*}{CH_{3}\to^{*}CH_{2}}的过程中{C}$被氧化,释放能量
C.产物从催化剂表面脱附的速率对总反应速率无影响
D.${CH_{4}}与{O_{2}}反应生成{CO}和{H_{2}}$的过程中只涉及极性键的断裂和生成
A
)
A.适当提高${O_{2}}分压可以加快{O_{2}(g)\to 2^{*}O}$的反应速率
B.$^{*}{CH_{3}\to^{*}CH_{2}}的过程中{C}$被氧化,释放能量
C.产物从催化剂表面脱附的速率对总反应速率无影响
D.${CH_{4}}与{O_{2}}反应生成{CO}和{H_{2}}$的过程中只涉及极性键的断裂和生成
答案:
A 解析:A.适当提高氧气分压,可以提高氧气的吸附速率,从而加快$O_{2}(g)\to 2^{\cdot }O$的反应速率,A正确;B.$^{\cdot }CH_{3}\to ^{\cdot }CH_{2}$的过程中,C元素的化合价升高,被氧化,$C-H$键断裂,断键吸收能量,B错误;C.若大量产物吸附在催化剂表面,则会减少$CH_{4}$和$O_{2}$在催化剂上的吸附面积,从而会降低总反应速率,C错误;D.$CH_{4}$和$O_{2}$反应生成$CO$和$H_{2}$的过程中涉及极性键、非极性键的断裂和生成,D错误。
12. 常温常压下,$1\ \unit{mol}\ {CH_{3}OH}与{O_{2}}$发生反应时,生成${CO}或{HCHO}$的能量变化如图(反应物${O_{2}}$和生成物水略去),下列说法正确的是 (

A.加入催化剂后,生成${CO}$的热效应变大,生成${HCHO}$的热效应变小
B.加入催化剂后,生成${HCHO}$的速率变大,单位时间内生成${HCHO}$量变多
C.$1\ \unit{mol}\ {CH_{3}OH}$完全燃烧生成液态水和二氧化碳(${g}$)放出$393\ \unit{kJ}$的热量
D.生成${HCHO}的热化学方程式为{2CH_{3}OH + O_{2}\xlongequal{}2HCHO + 2H_{2}O + 316\ \unit{kJ}}$
B
)
A.加入催化剂后,生成${CO}$的热效应变大,生成${HCHO}$的热效应变小
B.加入催化剂后,生成${HCHO}$的速率变大,单位时间内生成${HCHO}$量变多
C.$1\ \unit{mol}\ {CH_{3}OH}$完全燃烧生成液态水和二氧化碳(${g}$)放出$393\ \unit{kJ}$的热量
D.生成${HCHO}的热化学方程式为{2CH_{3}OH + O_{2}\xlongequal{}2HCHO + 2H_{2}O + 316\ \unit{kJ}}$
答案:
B 解析:A.加入催化剂只改变反应历程而不改热效应,加入催化剂生成$CO$的活化能增大而$HCHO$的活化能降低,A项错误;B.活化能越低反应越快。加入催化剂生成$CO$的活化能增大而$HCHO$的活化能降低,故生成$HCHO$速率更快,B项正确;C.$1molCH_{3}OH$完全燃烧生成液态水和一氧化碳(g)放出393kJ的热量,C项错误;D.该热化学方程式为没有标注物质的状态,D项错误。
13. 为实现“碳达峰、碳中和”的目标,科学家提出以${TiO_{2}}$为催化剂,用光热化学循环分解法,达到减少大气中${CO_{2}}$量的目的,反应的机理如图所示:
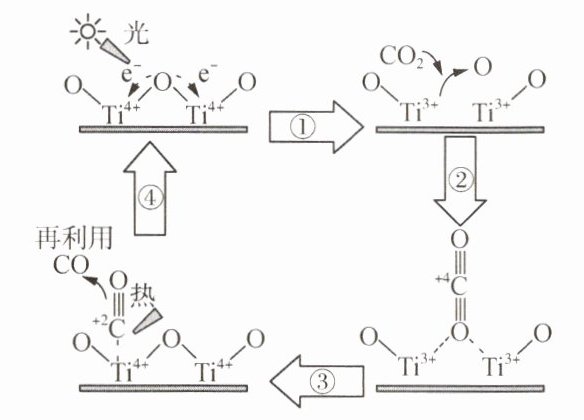

下列说法
A.过程①中光能转化为化学能
B.过程④为吸热过程
C.${TiO_{2}}$降低该反应的焓变,提高该反应速率
D.全过程热化学方程式为${2CO_{2}(g)\xlongequal{}2CO(g) + O_{2}(g)}$ \Delta H= +556\ \unit{kJ\cdot mol^{-1}}


下列说法
不
正
确
的是 (C
)A.过程①中光能转化为化学能
B.过程④为吸热过程
C.${TiO_{2}}$降低该反应的焓变,提高该反应速率
D.全过程热化学方程式为${2CO_{2}(g)\xlongequal{}2CO(g) + O_{2}(g)}$ \Delta H= +556\ \unit{kJ\cdot mol^{-1}}
答案:
C 解析:A.以$TiO_{2}$为催化剂的光热化学循环分解$CO_{2}$反应为温室气体减排提供了一个新途径,能量的变化形式是由光能转化为化学能,A正确;B.过程④需要从外界吸收热量,因此为吸热过程,B正确;C.$TiO_{2}$作为催化剂可以降低该反应的活化能,无法降低焓变,提高该反应速率,C错误;D.$CO_{2}$分解为$CO$和$O_{2}$化学方程式为$2CO_{2}=2CO+O_{2}$,根据分子化学键完全断裂时的能量变化图可知,$1mol$$CO_{2}$完全断裂应该吸收1598kJ,$1molCO$完全断裂应该吸收1072kJ,$1molO_{2}$完全断裂应该吸收496kJ;所以$1molCO_{2}$分解产生$1molCO$和$0.5molO_{2}$,所以需吸收$1598-1072-496× 0.5=278kJ$能量,则全过程热化学方程式为$2CO_{2}(g)=2CO(g)+O_{2}(g)$ $\Delta H=+556kJ\cdot mol^{-1}$,D正确。
14. 火箭发射时可以用液态肼作燃料,${NO_{2}}$作氧化剂。相关物质的能量转化关系如下。已知${N_{2}H_{4}(l){<=>[][]}N_{2}H_{4}(g)}$ $\Delta H= +9.7\ \unit{kJ/mol}$,则${2N_{2}H_{4}(l) + 2NO_{2}(g)\xlongequal{}3N_{2}(g) + 4H_{2}O(g)}的反应热\Delta H(\unit{kJ/mol})$为 (
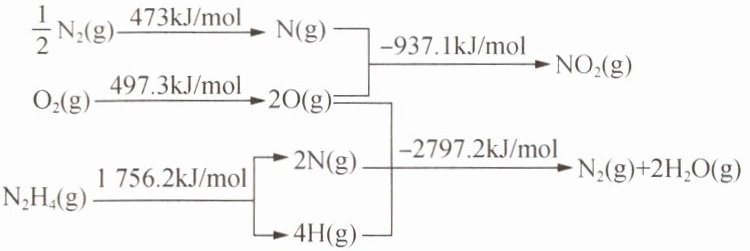
A.$-1134.4$
B.$-1153.8$
C.$-1631.7$
D.$-1054.4$
A
)
A.$-1134.4$
B.$-1153.8$
C.$-1631.7$
D.$-1054.4$
答案:
A 解析:根据图示信息,可得已知反应:①$\frac {1}{2}N_{2}(g)+O_{2}(g)=NO_{2}(g)$ $\Delta H=+33.2kJ/mol$②$O_{2}(g)+N_{2}H_{4}(g)=N_{2}(g)+2H_{2}O(g)$ $\Delta H=-543.7kJ/mol$ ③$N_{2}H_{4}(l)\rightleftharpoons N_{2}H_{4}(g)$ $\Delta H=+9.7kJ/mol$ ②$× 2+$③$× 2-$①$× 2$可得目标方程式:$2N_{2}H_{4}(l)+2NO_{2}(g)=3N_{2}(g)+4H_{2}O(g)$,所以$\Delta H=-543.7× 2+9.7× 2-33.2× 2=-1134.4kJ/mol$,
15. ${N_{2}O}和{CO}$是环境污染性气体,可在${Pt_{2}O}$表面转化为无害气体,其总反应为${N_{2}O(g) + CO(g)\xlongequal{}CO_{2}(g) + N_{2}(g)}\Delta H$,有关化学反应的物质变化过程及能量变化过程分别如图甲、乙所示。下列说法

A.${N_{2}O}$为氧化剂
B.$\Delta H= -226\ \unit{kJ\cdot mol^{-1}}$
C.由图乙知该反应正反应的活化能小于逆反应的活化能
D.为了实现转化,需不断向反应器中补充${Pt_{2}O}和{Pt_{2}O_{2}}$
不
正
确
的是 (D
)
A.${N_{2}O}$为氧化剂
B.$\Delta H= -226\ \unit{kJ\cdot mol^{-1}}$
C.由图乙知该反应正反应的活化能小于逆反应的活化能
D.为了实现转化,需不断向反应器中补充${Pt_{2}O}和{Pt_{2}O_{2}}$
答案:
D 解析:A.反应$N_{2}O(g)+CO(g)=CO_{2}(g)+N_{2}(g)$中,N元素化合价降低,$N_{2}O$为氧化剂,故A正确;B.反应物能量高于生成物,反应为放热反应,反应焓变$\Delta H=$生成物总能量一反应物总能量=134kJ/mol-360kJ/mol=-226kJ·mol^{-1},故B正确;C.由图乙知该反应正反应的活化能$E_{a}$小于逆反应的活化能$E_{b}$,故C正确;D.$Pt_{2}O$和$Pt_{2}O_{2}$是催化剂,催化剂在化学反应的前后化学性质和质量是不变的,无需不断补充,故D错误。
查看更多完整答案,请扫码查看


