第33页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
20. 一种以$MgCl_{2}$—聚乙烯醇为电解液的镁电池如图所示。下列说法不正确的是(

A.放电时,正极的电极反应式为$Mg^{2+}+2e^{-}+V_{2}O_{5}= MgV_{2}O_{5}$
B.放电一段时间后,聚乙烯醇中的$c(Mg^{2+})$几乎保持不变
C.充电时,$Mg^{2+}嵌入V_{2}O_{5}$晶格中
D.若将电解液换成$MgCl_{2}$水溶液,工作时电池可能产生鼓包
C
)
A.放电时,正极的电极反应式为$Mg^{2+}+2e^{-}+V_{2}O_{5}= MgV_{2}O_{5}$
B.放电一段时间后,聚乙烯醇中的$c(Mg^{2+})$几乎保持不变
C.充电时,$Mg^{2+}嵌入V_{2}O_{5}$晶格中
D.若将电解液换成$MgCl_{2}$水溶液,工作时电池可能产生鼓包
答案:
C 解析:图中装置,放电时Mg作负极, $ \text{V}_{2}\text{O}_{5} $作正极。A.由图中可知,放电时负极电极式为 $ \text{Mg}-2e^{-}=\text{Mg}^{2+} $,正极电极式为 $ \text{Mg}^{2+}+2e^{-}+\text{V}_{2}\text{O}_{5}=\text{MgV}_{2}\text{O}_{5} $,A正确;B.由放电时电池总反应式: $ \text{V}_{2}\text{O}_{5}+\text{Mg}=\text{MgV}_{2}\text{O}_{5} $知,放电不影响电解质溶液的 $ \text{Mg}^{2+} $浓度,故一段时间后,聚乙烯醇中的 $ c(\text{Mg}^{2+}) $几乎保持不变,B正确;C.充电时阳极电极式为 $ \text{MgV}_{2}\text{O}_{5}-2e^{-}=\text{V}_{2}\text{O}_{5}+\text{Mg}^{2+} $, $ \text{Mg}^{2+} $从 $ \text{V}_{2}\text{O}_{5} $中脱离,C错误;D.若将电解液换成 $ \text{MgCl}_{2} $水溶液,Mg能与水缓慢反应生成 $ \text{H}_{2} $,工作时电池可能产生鼓包,D正确。
21. 近期科技工作者开发了一套以乙醇为原料制备DDE( )的电解装置如下图所示。下列说法正确的是(
)的电解装置如下图所示。下列说法正确的是(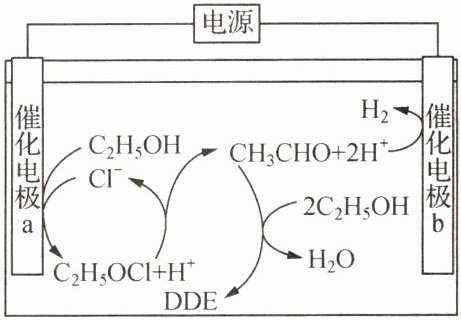
A.催化电极的电极电势:$b>a$
B.阴极电极反应式为$C_{2}H_{5}OH+Cl^{-}-2e^{-}= C_{2}H_{5}OCl+H^{+}$
C.电解后溶液的pH会减小(忽略溶液体积变化)
D.每产生1mol$H_{2}$需要消耗3mol$C_{2}H_{5}OH$
 )的电解装置如下图所示。下列说法正确的是(
)的电解装置如下图所示。下列说法正确的是(D
)
A.催化电极的电极电势:$b>a$
B.阴极电极反应式为$C_{2}H_{5}OH+Cl^{-}-2e^{-}= C_{2}H_{5}OCl+H^{+}$
C.电解后溶液的pH会减小(忽略溶液体积变化)
D.每产生1mol$H_{2}$需要消耗3mol$C_{2}H_{5}OH$
答案:
D 解析:A.b极氢离子生成氢气发生还原反应,为阴极,则催化电极的电极电势: $ \text{b}\lt\text{a} $,A错误;B.阴极反应得到电子的还原反应,反应为 $ 2\text{H}^{+}+2e^{-}=\text{H}_{2}\uparrow $,B错误;C.由图可知,反应中生成2个氢离子,又消耗2个氢离子,故pH值不变,C错误;D.由图可知,每产生 $ 1 \text{mol H}_{2} $的周期中,有1mol乙醇生成乙醛、乙醛又与2mol乙醇生成水和DDE,故需要消耗 $ 3 \text{mol C}_{2}\text{H}_{5}\text{OH} $,D正确。
22. 单液流锌镍电池以其成本低、效率高、寿命长等优势表现出较高的应用价值,电解液为ZnO溶解于碱性物质的产物$Zn(OH)_{4}^{2-}$,总反应为Zn+2NiOOH+ ,电池的工作原理如图所示。下列说法错误的是(
,电池的工作原理如图所示。下列说法错误的是(
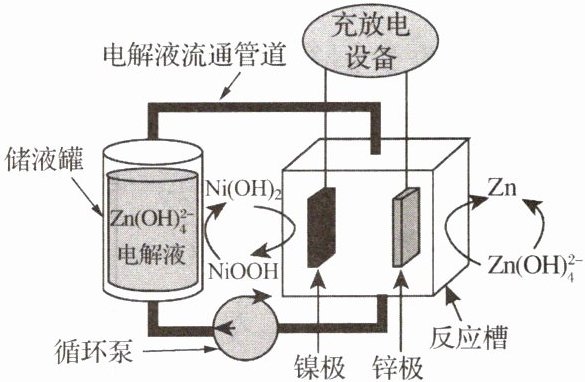
A.充电时,锌极发生的电极反应为$Zn(OH)_{4}^{2-}+2e^{-}= Zn+4OH^{-}$
B.放电时,镍极发生的电极反应为$NiOOH+H_{2}O+4e^{-}= Ni(OH)_{2}+OH^{-}$
C.充电时,阴离子从镍极区向锌极区移动,在锌极上反应生成$Zn(OH)_{4}^{2-}$
D.利用循环泵驱动电解液进行循环流动,可有效提高电池能量效率
 ,电池的工作原理如图所示。下列说法错误的是(
,电池的工作原理如图所示。下列说法错误的是(C
)
A.充电时,锌极发生的电极反应为$Zn(OH)_{4}^{2-}+2e^{-}= Zn+4OH^{-}$
B.放电时,镍极发生的电极反应为$NiOOH+H_{2}O+4e^{-}= Ni(OH)_{2}+OH^{-}$
C.充电时,阴离子从镍极区向锌极区移动,在锌极上反应生成$Zn(OH)_{4}^{2-}$
D.利用循环泵驱动电解液进行循环流动,可有效提高电池能量效率
答案:
C 解析:由总反应可知,放电时锌极上锌失去电子发生氧化反应为负极,镍极的NiOOH得到电子发生还原反应为正极。A.充电时,锌极为阴极,电极反应为 $ \text{Zn}(\text{OH})_{4}^{2-}+2e^{-}=\text{Zn}+4\text{OH}^{-} $,A正确;B.放电时,镍极为正极,电极反应为 $ \text{NiOOH}+\text{H}_{2}\text{O}+\text{e}^{-}=\text{Ni}(\text{OH})_{2}+\text{OH}^{-} $,B正确;C.充电时,镍极为阳极,阴离子从锌极区向镍极区移动, $ \text{Zn}(\text{OH})_{4}^{2-} $在锌极上得电子生成金属锌,C错误;D.利用循环泵驱动电解液使其通过输送管道在电池反应槽与储液罐之间循环流动,可有效抑制电池内部电解液的浓度差造成的影响,从而提高电池能量效率,D正确。
查看更多完整答案,请扫码查看


