第52页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
1.
CuS 是一种重要的 P 型半导体材料。以一种石膏渣[含 CaSO_4 及少量 Cu(OH)_2、Cu_2(OH)_2SO_4、Zn(OH)_2 等]为原料制备 CuS 的实验流程如下:

已知:常温下,$ K_{sp}(CuS)= 1.27×10^{-36} $,$ K_{sp}(ZnS)= 1.2×10^{-23} $。
(1)“浸取”时,生成$ [Cu(NH_{3})_{4}]^{2+} 与 [Zn(NH_{3})_{4}]^{2+} $等。Cu_2(OH)_2SO_4 参加反应的离子方程式为
(2)为测定“浸取”时 Cu 元素浸出率,需先测定石膏渣中 Cu 元素含量。称取 50.00g 石膏渣,加入足量稀 H_2SO_4 充分溶解,过滤并洗涤滤渣,将滤液转移至 250mL 容量瓶中,加水稀释至刻度;准确量取 25.00mL 稀释后的溶液于锥形瓶中,加入足量 KI 溶液($ 2Cu^{+}+4I^{-}= 2CuI↓+I_{2} $),用 0.02000mol·L⁻^1 Na_2S_2O_3 标准溶液滴定至终点($ 2S_{2}O_{3}^{2-}+I_{2}= S_{4}O_{6}^{2-}+2I^{-} $),平行滴定 3 次,平均消耗 Na_2S_2O_3 标准溶液 23.50mL。计算石膏渣中 Cu 元素质量分数(写出计算过程)
(3)“沉淀”时 Na_2S 溶液的用量不宜过多,其原因是
(4)循环“浸取”多次后,“滤液 X”中浓度增大的阳离子主要有
(5)CuS 的晶胞如图所示。1 个 CuS 晶胞含有
(6)将空气以一定流速通过加热的 CuS 试样,测得固体质量和流出气体中 SO_2 含量随温度的变化如图所示。在 200~300℃范围内,CuS 经历如下转化:CuS→Cu_2S→CuO·CuSO_4,固体质量减少的主要原因是
CuS 是一种重要的 P 型半导体材料。以一种石膏渣[含 CaSO_4 及少量 Cu(OH)_2、Cu_2(OH)_2SO_4、Zn(OH)_2 等]为原料制备 CuS 的实验流程如下:

已知:常温下,$ K_{sp}(CuS)= 1.27×10^{-36} $,$ K_{sp}(ZnS)= 1.2×10^{-23} $。
(1)“浸取”时,生成$ [Cu(NH_{3})_{4}]^{2+} 与 [Zn(NH_{3})_{4}]^{2+} $等。Cu_2(OH)_2SO_4 参加反应的离子方程式为
${Cu_{2}(OH)_{2}SO_{4} + 8NH_{3}\xlongequal{}2[Cu(NH_{3})_{4}]^{2 + } + SO^{2-}_{4} + 2OH^{-}}$
。(2)为测定“浸取”时 Cu 元素浸出率,需先测定石膏渣中 Cu 元素含量。称取 50.00g 石膏渣,加入足量稀 H_2SO_4 充分溶解,过滤并洗涤滤渣,将滤液转移至 250mL 容量瓶中,加水稀释至刻度;准确量取 25.00mL 稀释后的溶液于锥形瓶中,加入足量 KI 溶液($ 2Cu^{+}+4I^{-}= 2CuI↓+I_{2} $),用 0.02000mol·L⁻^1 Na_2S_2O_3 标准溶液滴定至终点($ 2S_{2}O_{3}^{2-}+I_{2}= S_{4}O_{6}^{2-}+2I^{-} $),平行滴定 3 次,平均消耗 Na_2S_2O_3 标准溶液 23.50mL。计算石膏渣中 Cu 元素质量分数(写出计算过程)
由反应关系$2Cu^{2 + }~I_{2}~2S_{2}O^{2-}_{3}$可知,$25.00\ \unit{mL}$稀释后的溶液中$n({Cu^{2 + }}) = 0.02000\ \unit{mol\cdot L^{-1}}×23.50×10^{-3}\ \unit{L} = 4.700×10^{-4}\ \unit{mol}$,石膏渣中铜元素质量$m = 4.700×10^{-4}\ \unit{mol}×64\ \unit{g\cdot mol^{-1}}×\frac{250}{25} = 0.3008\ \unit{g}$,质量分数为$\frac{0.3008\ \unit{g}}{50.00\ \unit{g}}×100\% = 0.6016\%$
。(3)“沉淀”时 Na_2S 溶液的用量不宜过多,其原因是
生成的${CuS}$沉淀中会混有${ZnS}$沉淀
。(4)循环“浸取”多次后,“滤液 X”中浓度增大的阳离子主要有
${[Zn(NH_{3})_{4}]^{2 + }}$和${Na^{+}}$
。(5)CuS 的晶胞如图所示。1 个 CuS 晶胞含有
6
个 S^2⁻。
(6)将空气以一定流速通过加热的 CuS 试样,测得固体质量和流出气体中 SO_2 含量随温度的变化如图所示。在 200~300℃范围内,CuS 经历如下转化:CuS→Cu_2S→CuO·CuSO_4,固体质量减少的主要原因是
${CuS}$生成${Cu_{2}S}$时失重的质量大于部分${Cu_{2}S}$生成${CuO\cdot CuSO_{4}}$时增重的质量
。
答案:
(1)${Cu_{2}(OH)_{2}SO_{4} + 8NH_{3}\xlongequal{}2[Cu(NH_{3})_{4}]^{2 + } + SO^{2-}_{4} + 2OH^{-}}$
(2)由反应关系$2Cu^{2 + }~I_{2}~2S_{2}O^{2-}_{3}$可知,$25.00\ \unit{mL}$稀释后的溶液中$n({Cu^{2 + }}) = 0.02000\ \unit{mol\cdot L^{-1}}×23.50×10^{-3}\ \unit{L} = 4.700×10^{-4}\ \unit{mol}$,石膏渣中铜元素质量$m = 4.700×10^{-4}\ \unit{mol}×64\ \unit{g\cdot mol^{-1}}×\frac{250}{25} = 0.3008\ \unit{g}$,质量分数为$\frac{0.3008\ \unit{g}}{50.00\ \unit{g}}×100\% = 0.6016\%$
(3)生成的${CuS}$沉淀中会混有${ZnS}$沉淀
(4)${[Zn(NH_{3})_{4}]^{2 + }}$和${Na^{+}}$
(5)$6$
(6)${CuS}$生成${Cu_{2}S}$时失重的质量大于部分${Cu_{2}S}$生成${CuO\cdot CuSO_{4}}$时增重的质量
(1)${Cu_{2}(OH)_{2}SO_{4} + 8NH_{3}\xlongequal{}2[Cu(NH_{3})_{4}]^{2 + } + SO^{2-}_{4} + 2OH^{-}}$
(2)由反应关系$2Cu^{2 + }~I_{2}~2S_{2}O^{2-}_{3}$可知,$25.00\ \unit{mL}$稀释后的溶液中$n({Cu^{2 + }}) = 0.02000\ \unit{mol\cdot L^{-1}}×23.50×10^{-3}\ \unit{L} = 4.700×10^{-4}\ \unit{mol}$,石膏渣中铜元素质量$m = 4.700×10^{-4}\ \unit{mol}×64\ \unit{g\cdot mol^{-1}}×\frac{250}{25} = 0.3008\ \unit{g}$,质量分数为$\frac{0.3008\ \unit{g}}{50.00\ \unit{g}}×100\% = 0.6016\%$
(3)生成的${CuS}$沉淀中会混有${ZnS}$沉淀
(4)${[Zn(NH_{3})_{4}]^{2 + }}$和${Na^{+}}$
(5)$6$
(6)${CuS}$生成${Cu_{2}S}$时失重的质量大于部分${Cu_{2}S}$生成${CuO\cdot CuSO_{4}}$时增重的质量
2.
高纯 ZnO 可用作电子元件材料。以次氧化锌酸浸液(主要含有 Zn²⁺、SO₄²⁻,还含有 Fe³⁺、Fe²⁺、Mn²⁺、Pb²⁺等)为原料制备高纯 ZnO 的实验流程如下:

已知:常温下,$ K_{sp}[Zn(OH)_{2}]= 2.1×10^{-16} $,$ K_{sp}[Fe(OH)_{2}]= 8.0×10^{-16} $,$ K_{sp}[Fe(OH)_{3}]= 4.0×10^{-38} $。
(1)“除铁”时,须将 Fe²⁺氧化为 Fe³⁺的原因是
(2)“除锰”反应的离子方程式为
(3)为考查 Zn 粉用量对“除铅”过程中铅元素去除率的影响,设计若干对照实验组,这些实验组控制不变的因素有:“除锰”滤液浓度与体积、反应温度、
(4)写出以“ZnSO₄ 溶液”为原料制备高纯 ZnO 的实验方案:
高纯 ZnO 可用作电子元件材料。以次氧化锌酸浸液(主要含有 Zn²⁺、SO₄²⁻,还含有 Fe³⁺、Fe²⁺、Mn²⁺、Pb²⁺等)为原料制备高纯 ZnO 的实验流程如下:

已知:常温下,$ K_{sp}[Zn(OH)_{2}]= 2.1×10^{-16} $,$ K_{sp}[Fe(OH)_{2}]= 8.0×10^{-16} $,$ K_{sp}[Fe(OH)_{3}]= 4.0×10^{-38} $。
(1)“除铁”时,须将 Fe²⁺氧化为 Fe³⁺的原因是
Zn(OH)₂与Fe(OH)₂沉淀时pH相近,不易通过调pH分离Fe²⁺和Zn²⁺;Zn(OH)₂与Fe(OH)₃沉淀时pH相差较大,易于通过调pH分离Fe³⁺和Zn²⁺
。(2)“除锰”反应的离子方程式为
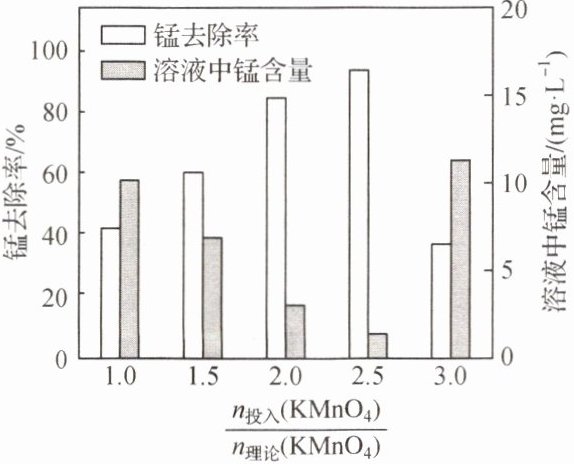
3Mn²⁺ + 2MnO₄⁻ + 2H₂O=5MnO₂↓ + 4H⁺
。其他条件不变时,$ \frac{n_{投入}(KMnO_{4})}{n_{理论}(KMnO_{4})} $与锰去除率、溶液中锰含量的关系如图所示。$ \frac{n_{投入}(KMnO_{4})}{n_{理论}(KMnO_{4})}>2.5 $时,溶液中锰去除率下降,其原因是过量的KMnO₄进入溶液
。
(3)为考查 Zn 粉用量对“除铅”过程中铅元素去除率的影响,设计若干对照实验组,这些实验组控制不变的因素有:“除锰”滤液浓度与体积、反应温度、
反应时间、搅拌速率
。(4)写出以“ZnSO₄ 溶液”为原料制备高纯 ZnO 的实验方案:
在搅拌下向ZnSO₄溶液中缓慢滴加氨水-NH₄HCO₃混合溶液;当向上层清液中继续滴加氨水-NH₄HCO₃溶液后不再产生沉淀时,过滤,所得滤渣用蒸馏水洗涤,直至最后一次洗涤滤液加入稀盐酸和BaCl₂溶液后不再产生浑浊;将所得沉淀烘干后灼烧至恒重
。[可选用的试剂:Na₂CO₃ 溶液、氨水—NH₄HCO₃ 混合溶液、蒸馏水、稀盐酸、BaCl₂ 溶液]
答案:
(1)Zn(OH)₂与Fe(OH)₂沉淀时pH相近,不易通过调pH分离Fe²⁺和Zn²⁺;Zn(OH)₂与Fe(OH)₃沉淀时pH相差较大,易于通过调pH分离Fe³⁺和Zn²⁺
(2)3Mn²⁺ + 2MnO₄⁻ + 2H₂O=5MnO₂↓ + 4H⁺ 过量的KMnO₄进入溶液
(3)反应时间、搅拌速率
(4)在搅拌下向ZnSO₄溶液中缓慢滴加氨水-NH₄HCO₃混合溶液;当向上层清液中继续滴加氨水-NH₄HCO₃溶液后不再产生沉淀时,过滤,所得滤渣用蒸馏水洗涤,直至最后一次洗涤滤液加入稀盐酸和BaCl₂溶液后不再产生浑浊;将所得沉淀烘干后灼烧至恒重
(1)Zn(OH)₂与Fe(OH)₂沉淀时pH相近,不易通过调pH分离Fe²⁺和Zn²⁺;Zn(OH)₂与Fe(OH)₃沉淀时pH相差较大,易于通过调pH分离Fe³⁺和Zn²⁺
(2)3Mn²⁺ + 2MnO₄⁻ + 2H₂O=5MnO₂↓ + 4H⁺ 过量的KMnO₄进入溶液
(3)反应时间、搅拌速率
(4)在搅拌下向ZnSO₄溶液中缓慢滴加氨水-NH₄HCO₃混合溶液;当向上层清液中继续滴加氨水-NH₄HCO₃溶液后不再产生沉淀时,过滤,所得滤渣用蒸馏水洗涤,直至最后一次洗涤滤液加入稀盐酸和BaCl₂溶液后不再产生浑浊;将所得沉淀烘干后灼烧至恒重
查看更多完整答案,请扫码查看


