第10页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
9. 下列离子方程式书写
$A. Na_2S_2O_3$与稀硫酸混合$:S_2O_3^2⁻ + 2H⁺ = S↓ + SO_2↑ + H_2O$
B. AgCl 悬浊液中加入足量的 KI 溶液:I⁻(aq) + AgCl(s) = AgI(s) + Cl⁻(aq)
C. FeO 与稀硝酸反应$:FeO + 2H⁺ = Fe^2⁺ + H_2O$
D. 用足量的氨水吸收烟气中的$ SO_2:2NH_3·H_2O + SO_2 = SO_3^2⁻ + 2NH_4⁺ + H_2O$
不
正
确
的是(C
)$A. Na_2S_2O_3$与稀硫酸混合$:S_2O_3^2⁻ + 2H⁺ = S↓ + SO_2↑ + H_2O$
B. AgCl 悬浊液中加入足量的 KI 溶液:I⁻(aq) + AgCl(s) = AgI(s) + Cl⁻(aq)
C. FeO 与稀硝酸反应$:FeO + 2H⁺ = Fe^2⁺ + H_2O$
D. 用足量的氨水吸收烟气中的$ SO_2:2NH_3·H_2O + SO_2 = SO_3^2⁻ + 2NH_4⁺ + H_2O$
答案:
C 解析:A. $Na_{2}S_{2}O_{3}$在酸性溶液中+2价的S发生歧化反应转变为S和$SO_{2}$,$Na_{2}S_{2}O_{3}$为可溶盐拆写为离子,反应为$S_{2}O_{3}^{2-}+2H^{+}=S\downarrow +SO_{2}\uparrow +H_{2}O$,A项正确;B. 溶解性小的AgCl转化为溶解性更小的AgI,反应为$I^{-}(aq)+AgCl(s)=AgI(s)+Cl^{-}(aq)$,B项正确;C. $HNO_{3}$具有强氧化性,能将$Fe^{2+}$氧化为$Fe^{3+}$,反应为$3FeO+10H^{+}+NO_{3}^{-}=3Fe^{3+}+5H_{2}O+NO\uparrow$,C项错误;D. 氨水和酸性氧化物反应产生盐和水,反应为$2NH_{3}\cdot H_{2}O+SO_{2}=SO_{3}^{2-}+2NH_{4}^{+}+H_{2}O$,D项正确。
10. 能正确表示下列反应的离子方程式的是(
A.将$ Na_2O_2$加入足量的稀盐酸中$:Na_2O_2 + 2H⁺ = 2Na⁺ + O_2↑ + H_2O$
B.用 Cu 电极电解 CuSO_4溶液:2Cu^2⁺ + 2H_2O $\xlongequal{通电}$ 4H⁺ + O_2↑ + Cu
C.过量的$ SO_2$通入$ Na_2CO_3$溶液中$:CO_3^2⁻ + SO_2 + H_2O = HSO_3⁻ + HCO_3⁻$
D.同浓度同体积的$ NH_4HSO_4$溶液与 NaOH 溶液混合$:H⁺ + OH⁻ = H_2O$
D
)A.将$ Na_2O_2$加入足量的稀盐酸中$:Na_2O_2 + 2H⁺ = 2Na⁺ + O_2↑ + H_2O$
B.用 Cu 电极电解 CuSO_4溶液:2Cu^2⁺ + 2H_2O $\xlongequal{通电}$ 4H⁺ + O_2↑ + Cu
C.过量的$ SO_2$通入$ Na_2CO_3$溶液中$:CO_3^2⁻ + SO_2 + H_2O = HSO_3⁻ + HCO_3⁻$
D.同浓度同体积的$ NH_4HSO_4$溶液与 NaOH 溶液混合$:H⁺ + OH⁻ = H_2O$
答案:
D 解析:A. 将$Na_{2}O_{2}$加入足量的稀盐酸中,根据得失电子守恒,离子反应方程式为$2Na_{2}O_{2}+4H^{+}=4Na^{+}+O_{2}\uparrow +2H_{2}O$,A错误;B. 用Cu电极电解$CuSO_{4}$溶液,Cu作阳极,发生放应:$Cu-2e^{-}=Cu^{2+}$,阴极反应为$Cu^{2+}+2e^{-}=Cu$,B错误;C. 因为酸性:$H_{2}SO_{3}>H_{2}CO_{3}$,所以过量的$SO_{2}$通入$Na_{2}CO_{3}$溶液中,$CO_{3}^{2-}+2SO_{2}+H_{2}O=2HSO_{3}^{-}+CO_{2}$,C错误;D. $NH_{4}HSO_{4}=NH_{4}^{+}+H^{+}+SO_{4}^{2-}$,同浓度同体积的$NH_{4}HSO_{4}$溶液与NaOH溶液混合,$OH^{-}$先与$H^{+}$反应,离子方程式为$H^{+}+OH^{-}=H_{2}O$,D正确。
11. 下列反应的离子方程式正确的是(
A.向$ Na_2SO_3$溶液中滴加稀$ HNO_3$溶液$:SO_3^2⁻ + 2H⁺ = SO_2↑ + H_2O$
B.用过量氨水吸收废气中的$ SO_2:NH_3·H_2O + SO_2 = HSO_3⁻ + NH_4⁺$
C.电解 MgCl_2水溶液的离子方程式:2Cl⁻ + 2H_2O $\xlongequal{通电}$ H_2↑ + Cl_2↑ + 2OH⁻
D.酸性$ K_2Cr_2O_7$溶液遇$ NaNO_2$变成绿色$:Cr_2O_7^2⁻ + 3NO_2⁻ + 8H⁺ = 3NO_3⁻ + 2Cr^3⁺ + 4H_2O$
D
)A.向$ Na_2SO_3$溶液中滴加稀$ HNO_3$溶液$:SO_3^2⁻ + 2H⁺ = SO_2↑ + H_2O$
B.用过量氨水吸收废气中的$ SO_2:NH_3·H_2O + SO_2 = HSO_3⁻ + NH_4⁺$
C.电解 MgCl_2水溶液的离子方程式:2Cl⁻ + 2H_2O $\xlongequal{通电}$ H_2↑ + Cl_2↑ + 2OH⁻
D.酸性$ K_2Cr_2O_7$溶液遇$ NaNO_2$变成绿色$:Cr_2O_7^2⁻ + 3NO_2⁻ + 8H⁺ = 3NO_3⁻ + 2Cr^3⁺ + 4H_2O$
答案:
D 解析:A. 向稀$HNO_{3}$中滴加$Na_{2}SO_{3}$溶液的离子反应为$3SO_{3}^{2-}+2NO_{3}^{-}+2H^{+}=3SO_{4}^{2-}+2NO\uparrow +H_{2}O$,故A错误;B. 用过量氨水吸收工业尾气中的$SO_{2}$,离子方程式$2NH_{3}\cdot H_{2}O+SO_{2}=2NH_{4}^{+}+SO_{3}^{2-}+H_{2}O$,故B错误;C. 电解$MgCl_{2}$水溶液生成氯气和氢氧化镁沉淀,离子方程式为$2Cl^{-}+Mg^{2+}+2H_{2}O\overset{通电}{=}H_{2}\uparrow +Cl_{2}\uparrow +Mg(OH)_{2}\downarrow$,故C错误;D. 酸性$K_{2}Cr_{2}O_{7}$溶液遇$NaNO_{2}$变成绿色,说明$Cr_{2}O_{7}^{2-}$被$NO_{2}^{-}$还原为$Cr^{3+}$,离子方程式为$Cr_{2}O_{7}^{2-}+3NO_{2}^{-}+8H^{+}=3NO_{3}^{-}+2Cr^{3+}+4H_{2}O$,故D正确。
12. 常温下,下列各组离子在给定溶液中可能大量共存的是(
A.在酸性溶液中$:Fe^2⁺、$$Mg^2⁺、$$SO_4^2⁻、$$NO_3⁻$
B.0.1 mol/L NaClO 溶液:H⁺、K⁺、$SO_3^2⁻、$Cl⁻
C.能使酚酞变红的溶液中:Na⁺、$Al^3⁺、$$HCO_3⁻、$$SO_4^2⁻$
D.加入铝片产生$ H_2$的溶液中:Na⁺、$Ba^2⁺、$$CH_3COO⁻、$$NO_3⁻$
D
)A.在酸性溶液中$:Fe^2⁺、$$Mg^2⁺、$$SO_4^2⁻、$$NO_3⁻$
B.0.1 mol/L NaClO 溶液:H⁺、K⁺、$SO_3^2⁻、$Cl⁻
C.能使酚酞变红的溶液中:Na⁺、$Al^3⁺、$$HCO_3⁻、$$SO_4^2⁻$
D.加入铝片产生$ H_2$的溶液中:Na⁺、$Ba^2⁺、$$CH_3COO⁻、$$NO_3⁻$
答案:
D 解析:A. 在酸性溶液中$Fe^{2+}$、$NO_{3}^{-}$之间发生氧化还原反应,不能大量共存,A不符合;B. 0.1 mol/L NaClO溶液中$H^{+}$、$Cl^{-}$、$ClO^{-}$之间发生氧化还原反应生成氯气,不能大量共存,B不符合;C. 能使酚酞变红的溶液显碱性,$Al^{3+}$、$HCO_{3}^{-}$均与氢氧根离子反应,且$Al^{3+}$、$HCO_{3}^{-}$会发生双水解不能大量共存,C不符合;D. 加入铝片产生$H_{2}$的溶液如果显碱性,$Na^{+}$、$Ba^{2+}$、$CH_{3}COO^{-}$、$NO_{3}^{-}$之间不反应,可以大量共存,D符合。
13. 现有下列实验探究摩尔盐$[(NH_4)_2Fe(SO_4)_2·6H_2O]$的化学性质。
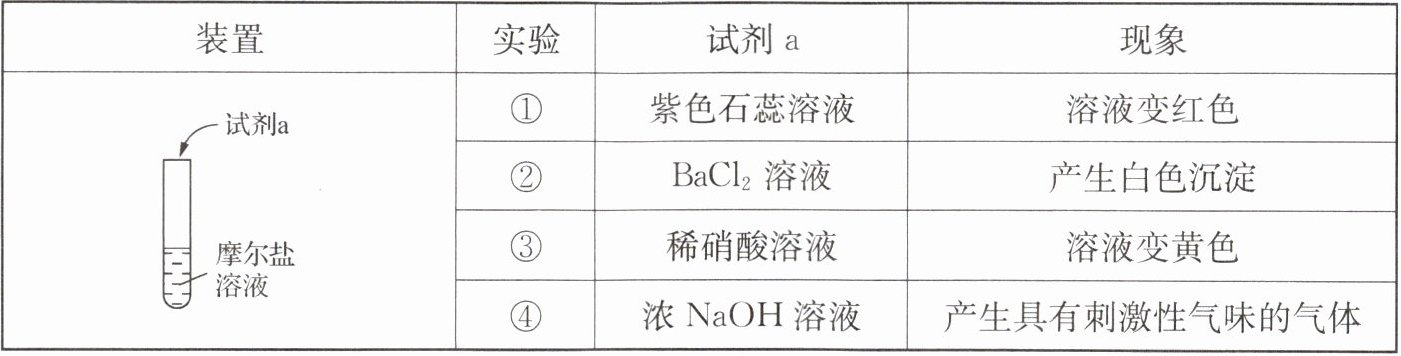
下列离子方程式
A.①中溶液变红:NH_4⁺ + H_2O $\rightleftharpoons$ NH_3·H_2O + H⁺、Fe^2⁺ + 2H_2O $\rightleftharpoons$ Fe(OH)_2 + 2H⁺
B.②中产生白色沉淀$:Ba^2⁺ + SO_4^2⁻ = BaSO_4↓$
C.③中溶液变黄$:Fe^2⁺ + NO_3⁻ + 2H⁺ = Fe^3⁺ + NO_2↑ + H_2O$
D.④中产生有刺激性气体$:NH_4⁺ + OH⁻ = NH_3↑ + H_2O$

下列离子方程式
不
能准确解释相应实验现象的是(C
)A.①中溶液变红:NH_4⁺ + H_2O $\rightleftharpoons$ NH_3·H_2O + H⁺、Fe^2⁺ + 2H_2O $\rightleftharpoons$ Fe(OH)_2 + 2H⁺
B.②中产生白色沉淀$:Ba^2⁺ + SO_4^2⁻ = BaSO_4↓$
C.③中溶液变黄$:Fe^2⁺ + NO_3⁻ + 2H⁺ = Fe^3⁺ + NO_2↑ + H_2O$
D.④中产生有刺激性气体$:NH_4⁺ + OH⁻ = NH_3↑ + H_2O$
答案:
C 解析:A. 铵根离子、亚铁离子水解使溶液显酸性,酸性溶液使紫色石蕊试液变红色,能准确解释相应实验现象,A不符合题意;B. 硫酸根离子和钡离子生成硫酸钡白色沉淀,能准确解释相应实验现象,B不符合题意;C. 亚铁离子和硝酸根离子生成铁离子和一氧化氮气体,$3Fe^{2+}+NO_{3}^{-}+4H^{+}=3Fe^{3+}+2H_{2}O+NO\uparrow$,不能准确解释相应实验现象,C符合题意;D. 铵根离子和氢氧根离子生成刺激性气体氨气,能准确解释相应实验现象,D不符合题意。
查看更多完整答案,请扫码查看


