第56页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
7.以废锰酸锂电池为原料,回收 MnO₂、精铜的实验流程如下:

(1)“浸取”在如图所示装置中进行。
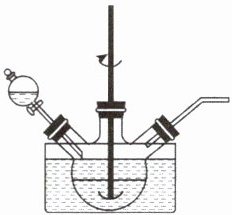
①将一定量“LiMn₂O₄ 和石墨混合粉末”与 H₂SO₄ 溶液、H₂O₂ 溶液中的一种配成悬浊液,加入三颈烧瓶中,75℃下通过滴液漏斗缓慢滴加另一种溶液。滴液漏斗中的溶液是
②LiMn₂O₄ 转化为 MnSO₄ 的化学方程式为
③保持温度、反应物和溶剂的量不变,能提高 Mn 元素浸出率的措施有
(2)补充以“铜箔和铝箔”为原料制备精铜的实验方案:
实验中须使用的试剂和物品:1.0mol·L⁻¹ NaOH 溶液、不锈钢片、H₂SO₄—CuSO₄ 混合溶液,除常用仪器外须使用的仪器:直流电源。
(3)通过下列方法测定 MnO₂ 的纯度:准确称取 0.4000g MnO₂ 样品,加入 25.00mL 0.2000mol·L⁻¹ Na₂C₂O₄ 溶液和适量硫酸,加热至完全反应(发生反应为$ MnO_{2}+C_{2}O_{4}^{2-}+4H^{+}= Mn^{2+}+2CO_{2}↑+2H_{2}O $),用 0.01000mol·L⁻¹ KMnO₄ 标准溶液滴定过量的 Na₂C₂O₄ 至终点,消耗 KMnO₄ 标准溶液 20.00mL(滴定反应为$ 2MnO_{4}^{-}+5C_{2}O_{4}^{2-}+16H^{+}= 2Mn^{2+}+10CO_{2}↑+8H_{2}O $)。计算样品中 MnO₂ 的质量分数(写出计算过程)解:$n(\text{KMnO}_4)=0.01000\ \text{mol·L}^{-1}×0.02000\ \text{L}=2.000×10^{-4}\ \text{mol}$
由$2\text{MnO}_4^-+5\text{C}_2\text{O}_4^{2-}+16\text{H}^+\xlongequal{}2\text{Mn}^{2+}+10\text{CO}_2\uparrow+8\text{H}_2\text{O}$可知,过量的$n(\text{C}_2\text{O}_4^{2-})=\frac{5}{2}n(\text{KMnO}_4)=\frac{5}{2}×2.000×10^{-4}\ \text{mol}=5.000×10^{-4}\ \text{mol}$
$n(\text{Na}_2\text{C}_2\text{O}_4)_{\text{总}}=0.2000\ \text{mol·L}^{-1}×0.02500\ \text{L}=5.000×10^{-3}\ \text{mol}$
与$\text{MnO}_2$反应的$n(\text{C}_2\text{O}_4^{2-})=5.000×10^{-3}\ \text{mol}-5.000×10^{-4}\ \text{mol}=4.500×10^{-3}\ \text{mol}$
由$\text{MnO}_2+\text{C}_2\text{O}_4^{2-}+4\text{H}^+\xlongequal{}\text{Mn}^{2+}+2\text{CO}_2\uparrow+2\text{H}_2\text{O}$可知,$n(\text{MnO}_2)=4.500×10^{-3}\ \text{mol}$
$m(\text{MnO}_2)=4.500×10^{-3}\ \text{mol}×87\ \text{g·mol}^{-1}=0.3915\ \text{g}$
$\text{MnO}_2$的质量分数$=\frac{0.3915\ \text{g}}{0.4000\ \text{g}}×100\%=97.875\%$。

(1)“浸取”在如图所示装置中进行。

①将一定量“LiMn₂O₄ 和石墨混合粉末”与 H₂SO₄ 溶液、H₂O₂ 溶液中的一种配成悬浊液,加入三颈烧瓶中,75℃下通过滴液漏斗缓慢滴加另一种溶液。滴液漏斗中的溶液是
H₂O₂
。②LiMn₂O₄ 转化为 MnSO₄ 的化学方程式为
2LiMn₂O₄ + 3H₂O₂ + 5H₂SO₄\xlongequal{75^{\circ}C}4MnSO₄ + Li₂SO₄ + 3O₂↑ + 8H₂O
。③保持温度、反应物和溶剂的量不变,能提高 Mn 元素浸出率的措施有
适当加快搅拌速率;延长反应时间
。(2)补充以“铜箔和铝箔”为原料制备精铜的实验方案:
边搅拌边向“铜箔和铝箔”中加入1.0 mol·L⁻¹ NaOH溶液,当溶液中不再产生气泡时,过滤;将铜箔压制成片并与直流电源正极相连,不锈钢片与直流电源负极相连,在H₂SO₄—CuSO₄混合溶液中电解,当铜箔完全溶解时取出不锈钢片,刮出精铜
;将所得精铜用蒸馏水洗净,干燥。实验中须使用的试剂和物品:1.0mol·L⁻¹ NaOH 溶液、不锈钢片、H₂SO₄—CuSO₄ 混合溶液,除常用仪器外须使用的仪器:直流电源。
(3)通过下列方法测定 MnO₂ 的纯度:准确称取 0.4000g MnO₂ 样品,加入 25.00mL 0.2000mol·L⁻¹ Na₂C₂O₄ 溶液和适量硫酸,加热至完全反应(发生反应为$ MnO_{2}+C_{2}O_{4}^{2-}+4H^{+}= Mn^{2+}+2CO_{2}↑+2H_{2}O $),用 0.01000mol·L⁻¹ KMnO₄ 标准溶液滴定过量的 Na₂C₂O₄ 至终点,消耗 KMnO₄ 标准溶液 20.00mL(滴定反应为$ 2MnO_{4}^{-}+5C_{2}O_{4}^{2-}+16H^{+}= 2Mn^{2+}+10CO_{2}↑+8H_{2}O $)。计算样品中 MnO₂ 的质量分数(写出计算过程)解:$n(\text{KMnO}_4)=0.01000\ \text{mol·L}^{-1}×0.02000\ \text{L}=2.000×10^{-4}\ \text{mol}$
由$2\text{MnO}_4^-+5\text{C}_2\text{O}_4^{2-}+16\text{H}^+\xlongequal{}2\text{Mn}^{2+}+10\text{CO}_2\uparrow+8\text{H}_2\text{O}$可知,过量的$n(\text{C}_2\text{O}_4^{2-})=\frac{5}{2}n(\text{KMnO}_4)=\frac{5}{2}×2.000×10^{-4}\ \text{mol}=5.000×10^{-4}\ \text{mol}$
$n(\text{Na}_2\text{C}_2\text{O}_4)_{\text{总}}=0.2000\ \text{mol·L}^{-1}×0.02500\ \text{L}=5.000×10^{-3}\ \text{mol}$
与$\text{MnO}_2$反应的$n(\text{C}_2\text{O}_4^{2-})=5.000×10^{-3}\ \text{mol}-5.000×10^{-4}\ \text{mol}=4.500×10^{-3}\ \text{mol}$
由$\text{MnO}_2+\text{C}_2\text{O}_4^{2-}+4\text{H}^+\xlongequal{}\text{Mn}^{2+}+2\text{CO}_2\uparrow+2\text{H}_2\text{O}$可知,$n(\text{MnO}_2)=4.500×10^{-3}\ \text{mol}$
$m(\text{MnO}_2)=4.500×10^{-3}\ \text{mol}×87\ \text{g·mol}^{-1}=0.3915\ \text{g}$
$\text{MnO}_2$的质量分数$=\frac{0.3915\ \text{g}}{0.4000\ \text{g}}×100\%=97.875\%$。
答案:
(1)①${H_{2}O_{2}}$
②${2LiMn_{2}O_{4} + 3H_{2}O_{2} + 5H_{2}SO_{4}\xlongequal{75^{\circ}C}4MnSO_{4} + Li_{2}SO_{4} + 3O_{2}\uparrow + 8H_{2}O}$
③适当加快搅拌速率;延长反应时间
(2)边搅拌边向“铜箔和铝箔”中加入$1.0\ \unit{mol\cdot L^{-1}}\ {NaOH}$溶液,当溶液中不再产生气泡时,过滤;将铜箔压制成片并与直流电源正极相连,不锈钢片与直流电源负极相连,在${H_{2}SO_{4} - CuSO_{4}}$混合溶液中电解,当铜箔完全溶解时取出不锈钢片,刮出精铜
(3)解:$n(\text{KMnO}_4)=0.01000\ \text{mol·L}^{-1}×0.02000\ \text{L}=2.000×10^{-4}\ \text{mol}$
由$2\text{MnO}_4^-+5\text{C}_2\text{O}_4^{2-}+16\text{H}^+\xlongequal{}2\text{Mn}^{2+}+10\text{CO}_2\uparrow+8\text{H}_2\text{O}$可知,过量的$n(\text{C}_2\text{O}_4^{2-})=\frac{5}{2}n(\text{KMnO}_4)=\frac{5}{2}×2.000×10^{-4}\ \text{mol}=5.000×10^{-4}\ \text{mol}$
$n(\text{Na}_2\text{C}_2\text{O}_4)_{\text{总}}=0.2000\ \text{mol·L}^{-1}×0.02500\ \text{L}=5.000×10^{-3}\ \text{mol}$
与$\text{MnO}_2$反应的$n(\text{C}_2\text{O}_4^{2-})=5.000×10^{-3}\ \text{mol}-5.000×10^{-4}\ \text{mol}=4.500×10^{-3}\ \text{mol}$
由$\text{MnO}_2+\text{C}_2\text{O}_4^{2-}+4\text{H}^+\xlongequal{}\text{Mn}^{2+}+2\text{CO}_2\uparrow+2\text{H}_2\text{O}$可知,$n(\text{MnO}_2)=4.500×10^{-3}\ \text{mol}$
$m(\text{MnO}_2)=4.500×10^{-3}\ \text{mol}×87\ \text{g·mol}^{-1}=0.3915\ \text{g}$
$\text{MnO}_2$的质量分数$=\frac{0.3915\ \text{g}}{0.4000\ \text{g}}×100\%=97.875\%$
(1)①${H_{2}O_{2}}$
②${2LiMn_{2}O_{4} + 3H_{2}O_{2} + 5H_{2}SO_{4}\xlongequal{75^{\circ}C}4MnSO_{4} + Li_{2}SO_{4} + 3O_{2}\uparrow + 8H_{2}O}$
③适当加快搅拌速率;延长反应时间
(2)边搅拌边向“铜箔和铝箔”中加入$1.0\ \unit{mol\cdot L^{-1}}\ {NaOH}$溶液,当溶液中不再产生气泡时,过滤;将铜箔压制成片并与直流电源正极相连,不锈钢片与直流电源负极相连,在${H_{2}SO_{4} - CuSO_{4}}$混合溶液中电解,当铜箔完全溶解时取出不锈钢片,刮出精铜
(3)解:$n(\text{KMnO}_4)=0.01000\ \text{mol·L}^{-1}×0.02000\ \text{L}=2.000×10^{-4}\ \text{mol}$
由$2\text{MnO}_4^-+5\text{C}_2\text{O}_4^{2-}+16\text{H}^+\xlongequal{}2\text{Mn}^{2+}+10\text{CO}_2\uparrow+8\text{H}_2\text{O}$可知,过量的$n(\text{C}_2\text{O}_4^{2-})=\frac{5}{2}n(\text{KMnO}_4)=\frac{5}{2}×2.000×10^{-4}\ \text{mol}=5.000×10^{-4}\ \text{mol}$
$n(\text{Na}_2\text{C}_2\text{O}_4)_{\text{总}}=0.2000\ \text{mol·L}^{-1}×0.02500\ \text{L}=5.000×10^{-3}\ \text{mol}$
与$\text{MnO}_2$反应的$n(\text{C}_2\text{O}_4^{2-})=5.000×10^{-3}\ \text{mol}-5.000×10^{-4}\ \text{mol}=4.500×10^{-3}\ \text{mol}$
由$\text{MnO}_2+\text{C}_2\text{O}_4^{2-}+4\text{H}^+\xlongequal{}\text{Mn}^{2+}+2\text{CO}_2\uparrow+2\text{H}_2\text{O}$可知,$n(\text{MnO}_2)=4.500×10^{-3}\ \text{mol}$
$m(\text{MnO}_2)=4.500×10^{-3}\ \text{mol}×87\ \text{g·mol}^{-1}=0.3915\ \text{g}$
$\text{MnO}_2$的质量分数$=\frac{0.3915\ \text{g}}{0.4000\ \text{g}}×100\%=97.875\%$
查看更多完整答案,请扫码查看


