第29页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
1. 用可再生能源电还原$CO_{2}$时,采用高浓度的$K^{+}$抑制酸性电解液中的析氢反应来提高多碳产物(乙烯、乙醇等)的生成率,装置如下图所示。下列说法正确的是(
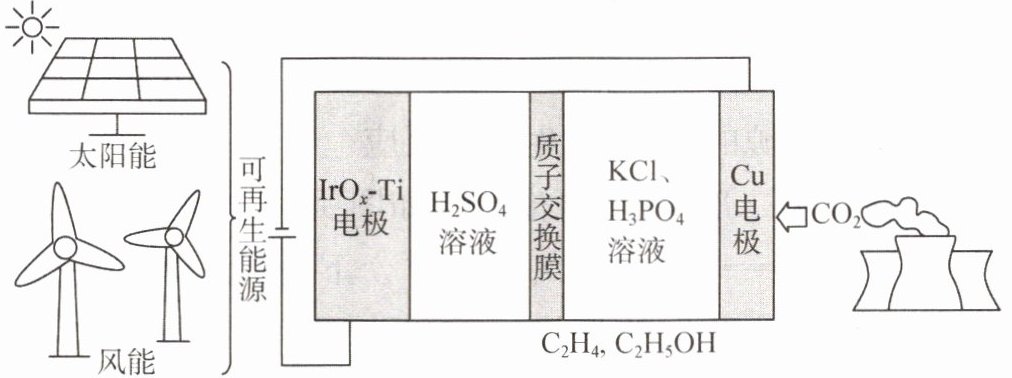
A.析氢反应发生在$IrO_{x}-Ti$电极上
B.$Cl^{-}从Cu电极迁移到IrO_{x}-Ti$电极
C.阴极发生的反应有:$2CO_{2}+12H^{+}+12e^{-}= C_{2}H_{4}+4H_{2}O$
D.每转移1mol电子,阳极生成11.2L气体(标准状况)
C
)
A.析氢反应发生在$IrO_{x}-Ti$电极上
B.$Cl^{-}从Cu电极迁移到IrO_{x}-Ti$电极
C.阴极发生的反应有:$2CO_{2}+12H^{+}+12e^{-}= C_{2}H_{4}+4H_{2}O$
D.每转移1mol电子,阳极生成11.2L气体(标准状况)
答案:
C
2. 某有色金属工业的高盐废水中主要含有$H^{+}$、$Cu^{2+}$、$Zn^{2+}$、$SO_{4}^{2-}$、$F^{-}和Cl^{-}$,利用如图电解装置可回收$ZnSO_{4}$、$CuSO_{4}并尽可能除去F^{-}和Cl^{-}$,其中双极膜(BP)中间层的$H_{2}O解离为H^{+}和OH^{-}$,并在直流电场作用下分别向两极迁移,M膜、N膜需在一价阴离子交换膜和阳离子交换膜中选择。下列说法
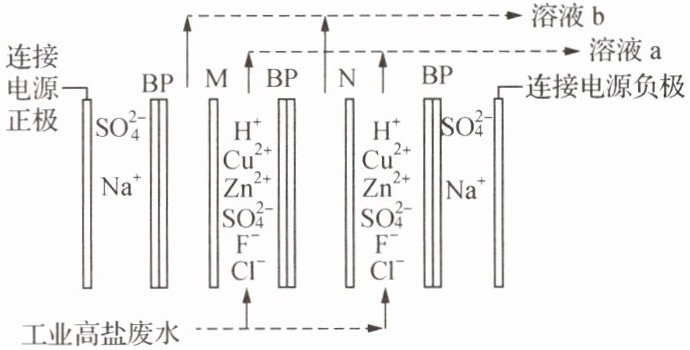
A.BP膜中$H^{+}$均向右侧溶液迁移,M膜为一价阴离子交换膜
B.溶液a的溶质主要为HF和HCl,溶液b的溶质主要为$ZnSO_{4}和CuSO_{4}$
C.当阳极产生22.4L气体(标准状况)时,有4mol离子通过N膜
D.电解过程中,应控制高盐废水的pH不能过高
错
误
的是(B
)
A.BP膜中$H^{+}$均向右侧溶液迁移,M膜为一价阴离子交换膜
B.溶液a的溶质主要为HF和HCl,溶液b的溶质主要为$ZnSO_{4}和CuSO_{4}$
C.当阳极产生22.4L气体(标准状况)时,有4mol离子通过N膜
D.电解过程中,应控制高盐废水的pH不能过高
答案:
B
3. 某低成本储能电池原理如图所示。下列说法正确的是(
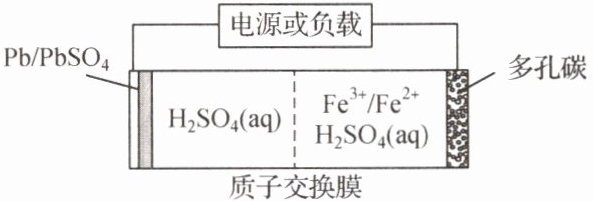
A.放电时负极质量减小
B.储能过程中电能转变为化学能
C.放电时右侧$H^{+}$通过质子交换膜移向左侧
D.充电总反应:$Pb+SO_{4}^{2-}+2Fe^{3+}= PbSO_{4}+2Fe^{2+}$
B
)
A.放电时负极质量减小
B.储能过程中电能转变为化学能
C.放电时右侧$H^{+}$通过质子交换膜移向左侧
D.充电总反应:$Pb+SO_{4}^{2-}+2Fe^{3+}= PbSO_{4}+2Fe^{2+}$
答案:
B解析:左侧电极为负极,电极反应为 $ \text{Pb}-2e^{-}+\text{SO}_{4}^{2-}=\text{PbSO}_{4} $,Pb 转化为 $ \text{PbSO}_{4} $,负极质量增大,A项错误;储能过程为充电过程,电能转化为化学能,B项正确;放电时阳离子向正极移动,左侧 $ \text{H}^{+} $通过质子交换膜移向右侧,C项错误;放电时总反应为 $ \text{Pb}+2\text{Fe}^{3+}+\text{SO}_{4}^{2-}=\text{PbSO}_{4}+2\text{Fe}^{2+} $,则充电总反应为 $ \text{PbSO}_{4}+2\text{Fe}^{2+}=\text{Pb}+2\text{Fe}^{3+}+\text{SO}_{4}^{2-} $,D项错误。
4. 新型$Li-Mg$双离子可充电电池是一种高效、低成本的储能电池,其工作原理如图所示。放电时电极a的反应为$Li_{1-x}FePO_{4}+xLi^{+}+xe^{-}= LiFePO_{4}$。下列说法
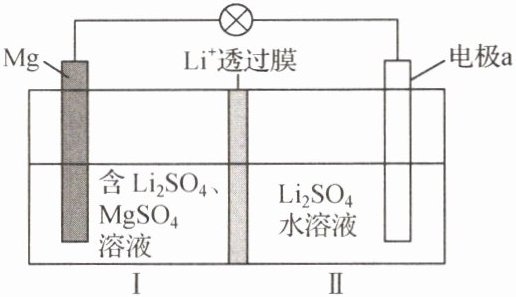
A.充电时,Mg电极为阴极
B.放电时,$Li^{+}$从Ⅰ室向Ⅱ室迁移
C.放电时,Ⅱ室$Li_{2}SO_{4}$溶液的浓度增大
D.每消耗1mol Mg,电极a质量理论上增加14g
不
正
确
的是(C
)
A.充电时,Mg电极为阴极
B.放电时,$Li^{+}$从Ⅰ室向Ⅱ室迁移
C.放电时,Ⅱ室$Li_{2}SO_{4}$溶液的浓度增大
D.每消耗1mol Mg,电极a质量理论上增加14g
答案:
C 解析:放电时电极a的反应为 $ \text{Li}_{1-x}\text{FePO}_{4}+x\text{Li}^{+}+xe^{-}=\text{LiFePO}_{4} $,电极a为正极,Mg电极为负极,所以充电时Mg电极为阴极,A项正确;放电时I室为负极区,II室为正极区,阳离子向正极移动,所以向II室迁移,B项正确;放电时电极a的反应为 $ \text{Li}_{1-x}\text{FePO}_{4}+x\text{Li}^{+}+xe^{-}=\text{LiFePO}_{4} $,消耗 $ \text{Li}^{+} $,同时相同数目的 $ \text{Li}^{+} $从I室移入II室,所以 $ \text{Li}_{2}\text{SO}_{4} $溶液的浓度不变,C项错误;放电时Mg电极发生反应: $ \text{Mg}-2e^{-}=\text{Mg}^{2+} $,当有1molMg发生反应时,转移 $ 2 \text{mol e}^{-} $,电极a质量理论上增加 $ 2 \text{mol Li}^{+} $,质量为14g,D项正确。
查看更多完整答案,请扫码查看


