第41页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
12. 有$ 0.1 mol·L⁻^1 $的三种溶液$:①CH_3COOH、$②NaOH、$③CH_3COONa,$下列说法正确的是 (
A.溶液①中$,c(CH_3COO⁻) = c(H⁺)$
B.溶液①②等体积混合,混合液中$ c(CH_3COO⁻)$等于溶液③中的$ c(CH_3COO⁻)$
C.溶液①②等体积混合,混合液中$ c(CH_3COO⁻) + c(CH_3COOH) = c(Na⁺)$
D.溶液①③等体积混合,混合液中$ c(Na⁺) > c(CH_3COO⁻) > c(H⁺) > c(OH⁻)$
C
)A.溶液①中$,c(CH_3COO⁻) = c(H⁺)$
B.溶液①②等体积混合,混合液中$ c(CH_3COO⁻)$等于溶液③中的$ c(CH_3COO⁻)$
C.溶液①②等体积混合,混合液中$ c(CH_3COO⁻) + c(CH_3COOH) = c(Na⁺)$
D.溶液①③等体积混合,混合液中$ c(Na⁺) > c(CH_3COO⁻) > c(H⁺) > c(OH⁻)$
答案:
C 解析:$ \mathrm{CH}_{3} \mathrm{COOH} $溶液中存在如下电荷守恒式:$ c\left(\mathrm{CH}_{3} \mathrm{COO}^{-}\right)+c\left(\mathrm{OH}^{-}\right)=c\left(\mathrm{H}^{+}\right) $,所以$ c\left(\mathrm{H}^{+}\right)>c\left(\mathrm{CH}_{3} \mathrm{COO}^{-}\right) $, A 项错误; ①②溶液等体积混合后得到浓度为$ 0.05 \mathrm{~mol} \cdot \mathrm{L}^{-1} $的$ \mathrm{CH}_{3} \mathrm{COONa} $溶液,溶液中$ c\left(\mathrm{CH}_{3} \mathrm{COO}^{-}\right) $比③溶液中$ c\left(\mathrm{CH}_{3} \mathrm{COO}^{-}\right) $小, B 项错误; $ \mathrm{CH}_{3} \mathrm{COONa} $溶液中存在物料守恒式:$ c\left(\mathrm{CH}_{3} \mathrm{COO}^{-}\right)+c\left(\mathrm{CH}_{3} \mathrm{COOH}\right)=c\left(\mathrm{Na}^{+}\right) $, C 项正确; $ \mathrm{CH}_{3} \mathrm{COOH} $和$ \mathrm{CH}_{3} \mathrm{COONa} $等浓度的混合溶液呈酸性,$ c\left(\mathrm{H}^{+}\right)>c\left(\mathrm{OH}^{-}\right) $,且溶液中存在电荷守恒式:$ c\left(\mathrm{CH}_{3} \mathrm{COO}^{-}\right)+c\left(\mathrm{OH}^{-}\right)=c\left(\mathrm{Na}^{+}\right)+c\left(\mathrm{H}^{+}\right) $,所以$ c\left(\mathrm{CH}_{3} \mathrm{COO}^{-}\right)>c\left(\mathrm{Na}^{+}\right) $, D 项错误。
13. 部分弱酸的电离平衡常数如表所示:
|弱酸|HCOOH|HCN|$H_2CO_3$|
|电离平衡常数(25℃)|$K = 1.77×10⁻^4$|$K = 4.9×10⁻^1⁰$|K_1 = 4.3×10⁻^7,K_2 = 5.6×10⁻^1^1|
下列说法正确的是 (
$A. 2CN⁻ + H_2O + CO_2 = 2HCN + CO_3^2⁻$
B. 中和等体积、等 pH 的 HCOOH 和 HCN 消耗 NaOH 的量前者大于后者
C. 物质的量浓度相等的 HCOONa 和 KCN 溶液中,c(Na⁺) - c(HCOO⁻) < c(K⁺) - c(CN⁻)
$D. c(NH_4⁺)$相等的$ HCOONH_4 $溶液、$NH_4CN $溶液、$NH_4HCO_3 $溶液中$: c(NH_4HCO_3) > c(NH_4CN) > c(HCOONH_4)$
|弱酸|HCOOH|HCN|$H_2CO_3$|
|电离平衡常数(25℃)|$K = 1.77×10⁻^4$|$K = 4.9×10⁻^1⁰$|K_1 = 4.3×10⁻^7,K_2 = 5.6×10⁻^1^1|
下列说法正确的是 (
C
)$A. 2CN⁻ + H_2O + CO_2 = 2HCN + CO_3^2⁻$
B. 中和等体积、等 pH 的 HCOOH 和 HCN 消耗 NaOH 的量前者大于后者
C. 物质的量浓度相等的 HCOONa 和 KCN 溶液中,c(Na⁺) - c(HCOO⁻) < c(K⁺) - c(CN⁻)
$D. c(NH_4⁺)$相等的$ HCOONH_4 $溶液、$NH_4CN $溶液、$NH_4HCO_3 $溶液中$: c(NH_4HCO_3) > c(NH_4CN) > c(HCOONH_4)$
答案:
C 解析:根据表中数据可以判断酸性强弱:$ \mathrm{HCOOH}>\mathrm{H}_{2} \mathrm{CO}_{3}>\mathrm{HCN}>\mathrm{HCO}_{3}^{-} $。A 项,应生成$ \mathrm{HCO}_{3}^{-} $; B 项,$ \mathrm{HCN} $消耗的$ \mathrm{NaOH} $多; C 项,$ c\left(\mathrm{Na}^{+}\right)-c\left(\mathrm{HCOO}^{-}\right)=c\left(\mathrm{OH}^{-}\right)-c\left(\mathrm{H}^{+}\right) $, $ c\left(\mathrm{~K}^{+}\right)-c\left(\mathrm{CN}^{-}\right)=c\left(\mathrm{OH}^{-}\right)-c\left(\mathrm{H}^{+}\right) $,后者碱性强,所以后者$ c\left(\mathrm{OH}^{-}\right)-c\left(\mathrm{H}^{+}\right) $的值大; D 项,都相互促进水解,其中促进程度$ \mathrm{CN}^{-}>\mathrm{HCO}_{3}^{-}>\mathrm{HCOO}^{-} $,促进程度越大,此盐浓度越大,所以$ c\left(\mathrm{NH}_{4} \mathrm{CN}\right)>c\left(\mathrm{NH}_{4} \mathrm{HCO}_{3}\right)>c\left(\mathrm{HCOONH}_{4}\right) $。
14. 常温下,若 HA 溶液和 NaOH 溶液混合后 pH = 7,下列说法
A.反应后 HA 溶液可能有剩余
B.生成物 NaA 的水溶液的 pH 可能小于 7
C.HA 溶液和 NaOH 溶液的体积可能不相等
D.HA 溶液的 c(H⁺)和 NaOH 溶液的 c(OH⁻)可能不相等
不
合
理
的是 (B
)A.反应后 HA 溶液可能有剩余
B.生成物 NaA 的水溶液的 pH 可能小于 7
C.HA 溶液和 NaOH 溶液的体积可能不相等
D.HA 溶液的 c(H⁺)和 NaOH 溶液的 c(OH⁻)可能不相等
答案:
B 解析:若$ \mathrm{HA} $是弱酸,则二者反应生成$ \mathrm{NaA} $显碱性,所以$ \mathrm{HA} $过量时,溶液才可能呈中性, A 项正确; 若二者等体积混合,溶液呈中性,则$ \mathrm{HA} $一定是强酸,所以$ \mathrm{NaA} $的水溶液的$ \mathrm{pH} $不可能小于 7,$ \mathrm{pH} $应大于或等于 7, B 项错误; 若$ \mathrm{HA} $为弱酸,则$ \mathrm{HA} $的物质的量大于氢氧化钠的物质的量,且二者的浓度的大小未知,所以$ \mathrm{HA} $溶液和$ \mathrm{NaOH} $溶液的体积可能不相等, C 项正确; $ \mathrm{HA} $溶液的$ c\left(\mathrm{H}^{+}\right) $和$ \mathrm{NaOH} $溶液的$ c\left(\mathrm{OH}^{-}\right) $可能不相等,混合后只要氢离子浓度与氢氧根离子浓度相等即可, D 项正确。
15. 常温下,向$ 10 mL b mol·L⁻^1 $的$ CH_3COOH $溶液中滴加等体积的$ 0.01 mol·L⁻^1 $的 NaOH 溶液,充分反应后溶液中$ c(Na⁺) = c(CH_3COO⁻),$下列说法不正确的是 (
A.b > 0.01
B.混合后溶液呈中性
$C.CH_3COOH $的电离常数$ Kₐ = 1.0×10⁻^9 / (b - 0.01) mol·L⁻^1$
D.向$ CH_3COOH $溶液中滴加 NaOH 溶液的过程中,水的电离程度逐渐减小
D
)A.b > 0.01
B.混合后溶液呈中性
$C.CH_3COOH $的电离常数$ Kₐ = 1.0×10⁻^9 / (b - 0.01) mol·L⁻^1$
D.向$ CH_3COOH $溶液中滴加 NaOH 溶液的过程中,水的电离程度逐渐减小
答案:
D 解析:因为$ \mathrm{CH}_{3} \mathrm{COOH} $为弱酸,$ \mathrm{NaOH} $为强碱,反应生成$ \mathrm{CH}_{3} \mathrm{COONa} $,根据电荷守恒可得$ c\left(\mathrm{Na}^{+}\right)+c\left(\mathrm{H}^{+}\right)=c\left(\mathrm{CH}_{3} \mathrm{COO}^{-}\right)+c\left(\mathrm{OH}^{-}\right) $,因为$ c\left(\mathrm{Na}^{+}\right)=c\left(\mathrm{CH}_{3} \mathrm{COO}^{-}\right) $,可得$ c\left(\mathrm{H}^{+}\right)=c\left(\mathrm{OH}^{-}\right) $,则混合后溶液呈中性,因为$ \mathrm{CH}_{3} \mathrm{COONa} $水解呈碱性,所以$ \mathrm{CH}_{3} \mathrm{COOH} $应过量,使溶液呈中性,所以$ b>0.01 $,故 A、B 两项正确; 反应后溶液呈中性,$ c\left(\mathrm{H}^{+}\right)=1.0 × 10^{-7} \mathrm{~mol} \cdot \mathrm{L}^{-1} $, $ c\left(\mathrm{CH}_{3} \mathrm{COO}^{-}\right)=c\left(\mathrm{Na}^{+}\right)=1 / 2 × 0.01 \mathrm{~mol} \cdot \mathrm{L}^{-1}=0.005 \mathrm{~mol} \cdot \mathrm{L}^{-1} $, $ c\left(\mathrm{CH}_{3} \mathrm{COOH}\right)=1 / 2 ×(b-0.01) \mathrm{mol} \cdot \mathrm{L}^{-1} $,所以$ \mathrm{CH}_{3} \mathrm{COOH} $的电离常数$ K_{\mathrm{a}}=\frac{1.0 × 10^{-9}}{b-0.01} \mathrm{~mol} \cdot \mathrm{L}^{-1} $, C 项正确; 向$ \mathrm{CH}_{3} \mathrm{COOH} $溶液中滴加$ \mathrm{NaOH} $溶液的过程中,水的电离程度先增大,$ \mathrm{CH}_{3} \mathrm{COOH} $完全反应后,再滴加$ \mathrm{NaOH} $溶液,水的电离程度减小, D 项错误。
16. T℃时,将一定浓度的$ Cd(NO_3)_2 $溶液分别滴加到一定浓度的 KOH、$K_2CO_3 $溶液中,生成沉淀的溶解平衡曲线关系如图所示(Xⁿ⁻ 表示 OH⁻ 或$ CO_3^2⁻)。$下列叙述正确的是 (
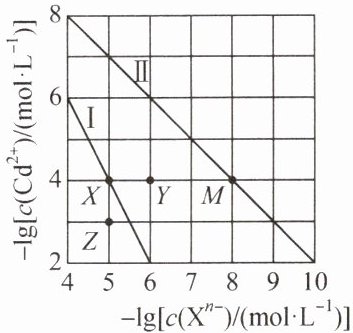
A.Ⅰ、Ⅱ 分别表示$ CdCO_3、$$Cd(OH)_2 $的沉淀溶解平衡曲线
$B.K_sp(CdCO_3) > K_sp[Cd(OH)_2],$且在水中$ Cd(OH)_2 $的溶解度更小
C.加热可使溶液由 X 点移至 Z 点
D.T℃时$,CdCO_3(s) + 2OH⁻(aq) ⇌ Cd(OH)_2(s) + CO_3^2⁻(aq)$的 K = 100
D
)
A.Ⅰ、Ⅱ 分别表示$ CdCO_3、$$Cd(OH)_2 $的沉淀溶解平衡曲线
$B.K_sp(CdCO_3) > K_sp[Cd(OH)_2],$且在水中$ Cd(OH)_2 $的溶解度更小
C.加热可使溶液由 X 点移至 Z 点
D.T℃时$,CdCO_3(s) + 2OH⁻(aq) ⇌ Cd(OH)_2(s) + CO_3^2⁻(aq)$的 K = 100
答案:
D 解析:$ K_{\mathrm{sp}}\left[\mathrm{Cd}(\mathrm{OH})_{2}\right]=c\left(\mathrm{Cd}^{2+}\right) \cdot c^{2}\left(\mathrm{OH}^{-}\right) $, $ -\lg c\left(\mathrm{Cd}^{2+}\right)=-2\left[-\lg c\left(\mathrm{OH}^{-}\right)\right]-\lg \left\{K_{\mathrm{sp}}\left[\mathrm{Cd}(\mathrm{OH})_{2}\right]\right\} $,曲线斜率为$ -2 $,则曲线Ⅰ表示$ \mathrm{Cd}(\mathrm{OH})_{2} $的沉淀溶解平衡曲线,曲线Ⅱ表示$ \mathrm{CdCO}_{3} $的沉淀溶解平衡曲线, A 项错误。由$ X $点$ (5,4) $可知,$ K_{\mathrm{sp}}\left[\mathrm{Cd}(\mathrm{OH})_{2}\right]=c\left(\mathrm{Cd}^{2+}\right) \cdot c^{2}\left(\mathrm{OH}^{-}\right)=10^{-4} ×\left(10^{-5}\right)^{2}=10^{-14} $; 由$ M $点$ (8,4) $可知,$ K_{\mathrm{sp}}\left(\mathrm{CdCO}_{3}\right)=c\left(\mathrm{Cd}^{2+}\right) \cdot c\left(\mathrm{CO}_{3}^{2-}\right)=10^{-4} × 10^{-8}=10^{-12} $,则$ K_{\mathrm{sp}}\left(\mathrm{CdCO}_{3}\right)>K_{\mathrm{sp}}\left[\mathrm{Cd}(\mathrm{OH})_{2}\right] $。设$ \mathrm{CdCO}_{3} $饱和溶液中$ \mathrm{CdCO}_{3} $的浓度为$ x \mathrm{~mol} \cdot \mathrm{L}^{-1} $,则$ c\left(\mathrm{Cd}^{2+}\right)=c\left(\mathrm{CO}_{3}^{2-}\right)=x \mathrm{~mol} \cdot \mathrm{L}^{-1} $, $ x^{2}=10^{-12} $,解得$ x=10^{-6} $,则$ \mathrm{CdCO}_{3} $在水中的溶解度约为$ 10^{-6} \mathrm{~mol} \cdot \mathrm{L}^{-1} × 172 \mathrm{~g} \cdot \mathrm{mol}^{-1} × 0.1 \mathrm{~L}=1.72 × 10^{-5} \mathrm{~g} $,同理可得$ \mathrm{Cd}(\mathrm{OH})_{2} $饱和溶液中,$ c\left(\mathrm{Cd}^{2+}\right) \approx 1.4 × 10^{-5} \mathrm{~mol} \cdot \mathrm{L}^{-1} $,则$ \mathrm{Cd}(\mathrm{OH})_{2} $在水中的溶解度约为$ 1.4 × 10^{-5} \mathrm{~mol} \cdot \mathrm{L}^{-1} × 146 \mathrm{~g} \cdot \mathrm{mol}^{-1} × 0.1 \mathrm{~L}=2.044 × 10^{-4} \mathrm{~g} $,由此可知,在水中$ \mathrm{CdCO}_{3} $的溶解度更小, B 项错误。曲线Ⅰ表示$ \mathrm{Cd}(\mathrm{OH})_{2} $的沉淀溶解平衡曲线,若加热,$ \mathrm{Cd}(\mathrm{OH})_{2} $在水中的溶解度增大,溶液中$ c\left(\mathrm{Cd}^{2+}\right) $和$ c\left(\mathrm{OH}^{-}\right) $均增大, C 项错误。$ \mathrm{CdCO}_{3}(\mathrm{~s})+2 \mathrm{OH}^{-}(\mathrm{aq}) \rightleftharpoons \mathrm{Cd}(\mathrm{OH})_{2}(\mathrm{~s})+\mathrm{CO}_{3}^{2-}(\mathrm{aq}) $的$ K=\frac{c\left(\mathrm{CO}_{3}^{2-}\right)}{c^{2}\left(\mathrm{OH}^{-}\right)}=\frac{c\left(\mathrm{Cd}^{2+}\right) \cdot c\left(\mathrm{CO}_{3}^{2-}\right)}{c\left(\mathrm{Cd}^{2+}\right) \cdot c^{2}\left(\mathrm{OH}^{-}\right)}=\frac{K_{\mathrm{sp}}\left(\mathrm{CdCO}_{3}\right)}{K_{\mathrm{sp}}\left[\mathrm{Cd}(\mathrm{OH})_{2}\right]}=\frac{10^{-12}}{10^{-14}}=100 $, D 项正确。
查看更多完整答案,请扫码查看


