第25页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
1. 天舟六号货运飞船成功发射,标志着我国航天事业进入到高质量发展新阶段。下列不能作为火箭推进剂的是 (
A.液氮—液氢
B.液氧—液氢
C.液态${NO_{2}}$—肼
D.液氧—煤油
A
)A.液氮—液氢
B.液氧—液氢
C.液态${NO_{2}}$—肼
D.液氧—煤油
答案:
A
2. 科学家进行如图所示的${CH_{3}OH}$制备及应用的研究,下列说法
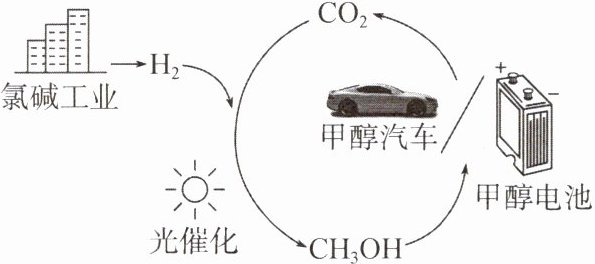
A.${CH_{3}OH}中{C}原子的杂化类型为{sp^{3}}$
B.$1\ \unit{mol}\ {CO_{2}}含有约2.2× 6.02× 10^{24}$个电子
C.${CO_{2}}和{H_{2}}合成甲醇符合原子利用率100\%$
D.图中涉及反应包含非极性键的断裂和生成
不
正
确
的是 (C
)
A.${CH_{3}OH}中{C}原子的杂化类型为{sp^{3}}$
B.$1\ \unit{mol}\ {CO_{2}}含有约2.2× 6.02× 10^{24}$个电子
C.${CO_{2}}和{H_{2}}合成甲醇符合原子利用率100\%$
D.图中涉及反应包含非极性键的断裂和生成
答案:
C
3. 常温下,1mol化学键分解成气态原子所需要的能量用E表示。结合表中信息判断下列说法不正确的是 (
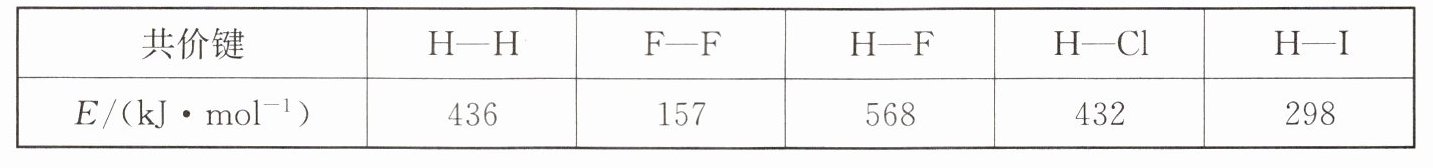
A.432\ \unit{kJ\cdot mol^{-1}}>E({H - Br})>298\ \unit{kJ\cdot mol^{-1}}
B.表中最稳定的共价键是${H - F}$键
C.{H_{2}(g)\to 2H(g)} \Delta H= +436\ \unit{kJ\cdot mol^{-1}}
D.{H_{2}(g) + F_{2}(g)\xlongequal{}2HF(g)} \Delta H= -25\ \unit{kJ\cdot mol^{-1}}
D
)
A.432\ \unit{kJ\cdot mol^{-1}}>E({H - Br})>298\ \unit{kJ\cdot mol^{-1}}
B.表中最稳定的共价键是${H - F}$键
C.{H_{2}(g)\to 2H(g)} \Delta H= +436\ \unit{kJ\cdot mol^{-1}}
D.{H_{2}(g) + F_{2}(g)\xlongequal{}2HF(g)} \Delta H= -25\ \unit{kJ\cdot mol^{-1}}
答案:
D 解析:依据溴原子半径大于氯原子半径而小于碘原子半径,半径越大键能越小,所以结合图表中数据可知$432kJ\cdot mol^{-1}{>}E(H-Br){>}298kJ\cdot mol^{-1}$,A项正确;键能越大形成的化学键越稳定,表中键能最大的是$H-F$,最稳定的共价键是$H-F$键,B项正确;氢气变化为氢原子吸热等于氢气中断裂化学键需要的能量,$H_{2}(g)\to 2H(g)$ $\Delta H=+436kJ\cdot mol^{-1}$,C项正确;依据键能计算,反应焓变=反应物键能总和一生成物键能总和,$\Delta H=+436kJ\cdot mol^{-1}+157kJ\cdot mol^{-1}-2× 568kJ\cdot mol^{-1}=-543kJ\cdot mol^{-1}$,$H_{2}(g)+F_{2}(g)=2HF(g)$ $\Delta H=-543kJ\cdot mol^{-1}$,D项错误。
4. 氢燃料是未来能源发展的方向之一,氢气的廉价获得与安全储存是科技界研究的重点,其中甲醇蒸气中催化重整是重要的工业制氢方案,发生的主要反应如下:
Ⅰ.${CH_{3}OH(g) + H_{2}O(g){<=>[][]}CO_{2}(g) + 3H_{2}(g)}$ $\Delta H_{1}$
Ⅱ.${CO_{2}(g) + H_{2}(g){<=>[][]}CO(g) + H_{2}O(g)}$ $\Delta H_{2}$
已知:①化学键的键能数据如表所示:
|化学键|${C\xlongequal{}O}$|${H - H}$|${H - O}$|${C - H}$|${C - O}$|
|键能$/(\unit{kJ\cdot mol^{-1}})$|799|436|463|414|343|
②${CO_{2}(g) + H_{2}(g){<=>[][]}CO(g) + H_{2}O(l)}$ $\Delta H= -2.8\ \unit{kJ\cdot mol^{-1}}$;
${H_{2}O(g){<=>[][]}H_{2}O(l)}$ $\Delta H= -41\ \unit{kJ\cdot mol^{-1}}$。
下列说法错误的是 (
A.${CO}$的电子式为:${C} : \vdots \vdots {O}:$
B.${CO}分子中共价键的键能为1069.8\ \unit{kJ\cdot mol^{-1}}$
C.反应I在低温条件下能自发进行,且该反应的活化能$E_{\text{a}}(正)\lt E_{\text{a}}(逆)$
D.升高温度,有利于提高氢气的产率及反应速率
Ⅰ.${CH_{3}OH(g) + H_{2}O(g){<=>[][]}CO_{2}(g) + 3H_{2}(g)}$ $\Delta H_{1}$
Ⅱ.${CO_{2}(g) + H_{2}(g){<=>[][]}CO(g) + H_{2}O(g)}$ $\Delta H_{2}$
已知:①化学键的键能数据如表所示:
|化学键|${C\xlongequal{}O}$|${H - H}$|${H - O}$|${C - H}$|${C - O}$|
|键能$/(\unit{kJ\cdot mol^{-1}})$|799|436|463|414|343|
②${CO_{2}(g) + H_{2}(g){<=>[][]}CO(g) + H_{2}O(l)}$ $\Delta H= -2.8\ \unit{kJ\cdot mol^{-1}}$;
${H_{2}O(g){<=>[][]}H_{2}O(l)}$ $\Delta H= -41\ \unit{kJ\cdot mol^{-1}}$。
下列说法错误的是 (
C
)A.${CO}$的电子式为:${C} : \vdots \vdots {O}:$
B.${CO}分子中共价键的键能为1069.8\ \unit{kJ\cdot mol^{-1}}$
C.反应I在低温条件下能自发进行,且该反应的活化能$E_{\text{a}}(正)\lt E_{\text{a}}(逆)$
D.升高温度,有利于提高氢气的产率及反应速率
答案:
C 解析:$CO$与$N_{2}$互为等电子体,因此它们的分子结构相似,则可由$N_{2}$的电子式推出$CO$的电子式为$:C\vdots \vdots O:$,A项正确。结合题给信息及盖斯定律可知反应$CO_{2}(g)+H_{2}(g)\rightleftharpoons CO(g)+H_{2}O(g)$的$\Delta H_{2}=[-2.8-(-41)]kJ\cdot mol^{-1}=+38.2kJ\cdot mol^{-1}$,再根据$\Delta H=$反应物的总键能一生成物的总键能,可得$(2× 799kJ\cdot mol^{-1}+436kJ\cdot mol^{-1})-[E(CO)+2× 463kJ\cdot mol^{-1}]=+38.2kJ\cdot mol^{-1}$,$E(CO)=1069.8kJ\cdot mol^{-1}$,B项正确。由$\Delta H=$反应物的总键能一生成物的总键能可得,$\Delta H_{1}=(3× 414kJ\cdot mol^{-1}+343kJ\cdot mol^{-1}+3× 463kJ\cdot mol^{-1})-(2× 799kJ\cdot mol^{-1}+3× 436kJ\cdot mol^{-1})=+68kJ\cdot mol^{-1}$,$\Delta H_{1}>0$,$\Delta S_{1}>0$,根据自发条件$\Delta H-T\Delta S<0$推知,该反应在高温下能自发进行,该反应为吸热反应,所以正反应的活化能大于逆反应的活化能,C项错误。由上述分析可知,反应Ⅰ和反应Ⅱ均为吸热反应,升高温度,平衡均正向移动,但由于反应Ⅰ中生成氢气的量大于反应Ⅱ中消耗氢气的量,因此氢气的产率增大,升高温度,反应速率增大,D项正确。
5. 美国科罗拉多大学博尔德分校Kirkby、Jasper团队报道了碘酸作为大气气溶胶源的气相形成机理。下列叙述正确的是 (
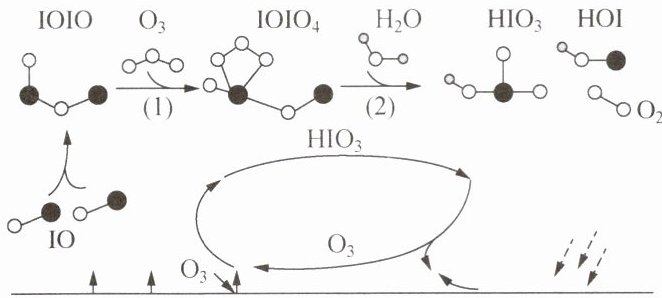
A.如图所示,${O_{3}}$是非极性分子
B.如图所示,${IO^{-}_{3}}$的空间结构为平面三角形
C.沸点(或熔点):${O_{3}}>{O_{2}}$
D.反应(1):${IOIO_{4} + H_{2}O\xlongequal{}HIO_{3} + HOI + O_{2}}$
C
)
A.如图所示,${O_{3}}$是非极性分子
B.如图所示,${IO^{-}_{3}}$的空间结构为平面三角形
C.沸点(或熔点):${O_{3}}>{O_{2}}$
D.反应(1):${IOIO_{4} + H_{2}O\xlongequal{}HIO_{3} + HOI + O_{2}}$
答案:
C 解析:$O_{3}$是V形分子,属于极性分子,A项错误;$IO_{3}^{-}$中Ⅰ采取$sp^{3}$杂化,呈三角锥形,B项错误;$O_{3}$、$O_{2}$都是分子晶体,$O_{3}$的相对分子质量大于$O_{2}$,$O_{3}$的分子间作用力大于$O_{2}$,C项正确;根据图示,反应
(1)为$IOIO+O_{3}=IOIO_{4}$,D项错误。
(1)为$IOIO+O_{3}=IOIO_{4}$,D项错误。
查看更多完整答案,请扫码查看


