第53页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
3.
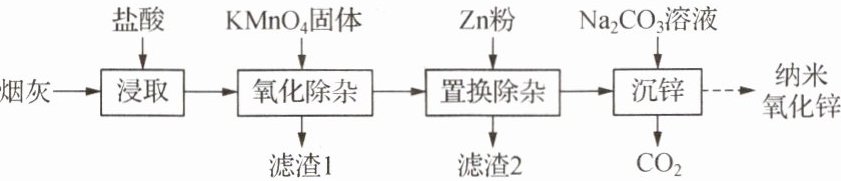
纳米氧化锌是一种新型无机功能材料。以氧化锌烟灰(含 ZnO 及少量$ Fe_2O_3、$FeO、MnO、CuO)为原料制备纳米氧化锌的工艺流程如图:
如表列出了相关金属离子生成氢氧化物沉淀的 pH(开始沉淀的 pH 按金属离子浓度为$ 0.1mol·L⁻^1 $计算)。
|金属离子|$Fe^3⁺$|$Fe^2⁺$|$Cu^2⁺$|$Zn^2⁺$|$Mn^2⁺$|
|开始沉淀的 pH|1.5|6.3|6.0|6.2|8.1|
|完全沉淀的 pH|2.8|8.3|8.0|8.2|10.1|
(1)$Cu^2⁺$基态核外电子排布式为
(2)“浸取”过程中盐酸不宜过量太多,其可能原因是
(3)“滤渣 1”的成分是$ MnO_2、$$Fe(OH)_3$。“氧化除杂”过程中$ KMnO_4 $与$ Mn^2⁺$发生反应的离子方程式为
(4)①“沉锌”得到碱式碳酸锌[化学式为$ 2ZnCO_3·3Zn(OH)_2·2H_2O],$该反应的离子方程式为
②碱式碳酸锌加热升温过程中固体的质量变化如图所示。350℃时,剩余固体中已不含碳元素,则剩余固体中含有

纳米氧化锌是一种新型无机功能材料。以氧化锌烟灰(含 ZnO 及少量$ Fe_2O_3、$FeO、MnO、CuO)为原料制备纳米氧化锌的工艺流程如图:

如表列出了相关金属离子生成氢氧化物沉淀的 pH(开始沉淀的 pH 按金属离子浓度为$ 0.1mol·L⁻^1 $计算)。
|金属离子|$Fe^3⁺$|$Fe^2⁺$|$Cu^2⁺$|$Zn^2⁺$|$Mn^2⁺$|
|开始沉淀的 pH|1.5|6.3|6.0|6.2|8.1|
|完全沉淀的 pH|2.8|8.3|8.0|8.2|10.1|
(1)$Cu^2⁺$基态核外电子排布式为
${1s^{2} 2s^{2} 2p^{6} 3s^{2} 3p^{6} 3d^{9}}$或者${[Ar] 3d^{9}}$
。(2)“浸取”过程中盐酸不宜过量太多,其可能原因是
防止后续“氧化除杂”步骤中消耗更多的${KMnO_{4}}$和产生污染性气体${Cl_{2}}$
。(3)“滤渣 1”的成分是$ MnO_2、$$Fe(OH)_3$。“氧化除杂”过程中$ KMnO_4 $与$ Mn^2⁺$发生反应的离子方程式为
${2MnO^{-}_{4} + 3Mn^{2 + } + 2H_{2}O\xlongequal{}5MnO_{2}\downarrow + 4H^{+}}$
,溶液 pH 范围应控制在$2.8 ~ 6.0$
。(4)①“沉锌”得到碱式碳酸锌[化学式为$ 2ZnCO_3·3Zn(OH)_2·2H_2O],$该反应的离子方程式为
${5Zn^{2 + } + 5CO^{2-}_{3} + 5H_{2}O\xlongequal{}2ZnCO_{3}\cdot 3Zn(OH)_{2}\cdot 2H_{2}O\downarrow + 3CO_{2}\uparrow}$
。②碱式碳酸锌加热升温过程中固体的质量变化如图所示。350℃时,剩余固体中已不含碳元素,则剩余固体中含有
${ZnO}$和${Zn(OH)_{2}}$
(填化学式)。
答案:
(1)${1s^{2} 2s^{2} 2p^{6} 3s^{2} 3p^{6} 3d^{9}}$或者${[Ar] 3d^{9}}$
(2)防止后续“氧化除杂”步骤中消耗更多的${KMnO_{4}}$和产生污染性气体${Cl_{2}}$
(3)${2MnO^{-}_{4} + 3Mn^{2 + } + 2H_{2}O\xlongequal{}5MnO_{2}\downarrow + 4H^{+}}$ $2.8 ~ 6.0$
(4)①${5Zn^{2 + } + 5CO^{2-}_{3} + 5H_{2}O\xlongequal{}2ZnCO_{3}\cdot 3Zn(OH)_{2}\cdot 2H_{2}O\downarrow + 3CO_{2}\uparrow}$
②${ZnO}$和${Zn(OH)_{2}}$
(1)${1s^{2} 2s^{2} 2p^{6} 3s^{2} 3p^{6} 3d^{9}}$或者${[Ar] 3d^{9}}$
(2)防止后续“氧化除杂”步骤中消耗更多的${KMnO_{4}}$和产生污染性气体${Cl_{2}}$
(3)${2MnO^{-}_{4} + 3Mn^{2 + } + 2H_{2}O\xlongequal{}5MnO_{2}\downarrow + 4H^{+}}$ $2.8 ~ 6.0$
(4)①${5Zn^{2 + } + 5CO^{2-}_{3} + 5H_{2}O\xlongequal{}2ZnCO_{3}\cdot 3Zn(OH)_{2}\cdot 2H_{2}O\downarrow + 3CO_{2}\uparrow}$
②${ZnO}$和${Zn(OH)_{2}}$
查看更多完整答案,请扫码查看


