第14页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
7. 工业制取$SO_{2}的主要反应为4FeS_{2}+11O_{2}\xlongequal {煅烧}2Fe_{2}O_{3}+8SO_{2}$。下列说法正确的是 ( )
A.中子数为 10 的氧原子:$_{8}^{18}O$
B.$Fe^{2+}价层电子排布式为3d^{5}4s^{1}$
C.$SO_{2}$分子空间构型为直线形
D.硫原子结构示意图: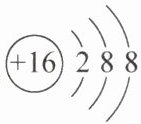
A.中子数为 10 的氧原子:$_{8}^{18}O$
B.$Fe^{2+}价层电子排布式为3d^{5}4s^{1}$
C.$SO_{2}$分子空间构型为直线形
D.硫原子结构示意图:

答案:
7.A 解析:A. 核素的表示方法为:元素符号左下角为质子数,左上角为质量数;中子数为10的氧原子:$_{8}^{18}O$,A正确;B. 铁失去2个电子后得到亚铁离子,$Fe^{2 + }$价层电子排布式为$3d^{6}$,B错误;C. $SO_{2}$分子中中心S原子价层电子对数为$2+\frac{6 - 2×2}{2}=3$,S原子采用$sp^{2}$杂化,空间构型是V形,C错误;D. 硫原子的最外层电子数为6,原子结构示意图: ,D错误。
,D错误。
7.A 解析:A. 核素的表示方法为:元素符号左下角为质子数,左上角为质量数;中子数为10的氧原子:$_{8}^{18}O$,A正确;B. 铁失去2个电子后得到亚铁离子,$Fe^{2 + }$价层电子排布式为$3d^{6}$,B错误;C. $SO_{2}$分子中中心S原子价层电子对数为$2+\frac{6 - 2×2}{2}=3$,S原子采用$sp^{2}$杂化,空间构型是V形,C错误;D. 硫原子的最外层电子数为6,原子结构示意图:
 ,D错误。
,D错误。 8. 碱式碳酸氧钒铵晶体$[(NH_{4})_{5}(VO)_{6}(CO_{3})_{4}(OH)_{9}\cdot 10H_{2}O]$是制备多种含钒产品的原料。有关说法
A.$NH_{4}^{+}$的空间构型为正四面体形
B.基态$V^{4+}的核外电子排布式为[Ar]3d^{1}$
C.$CO_{3}^{2-}$中 C 的轨道杂化类型为$sp^{2}$杂化
D.$H_{2}O$是非极性分子
不
正
确
的是 (D
)A.$NH_{4}^{+}$的空间构型为正四面体形
B.基态$V^{4+}的核外电子排布式为[Ar]3d^{1}$
C.$CO_{3}^{2-}$中 C 的轨道杂化类型为$sp^{2}$杂化
D.$H_{2}O$是非极性分子
答案:
8.D 解析:A. N原子价层电子对数为$4+\frac{5 - 1 - 1×4}{2}=4$,采用$sp^{3}$杂化,$NH_{4}^{+}$的空间构型为正四面体形,故A正确;B. 23号钒元素基态$V^{4 + }$的核外电子排布式为[Ar]$3d^{1}$,故B正确;C. $CO_{3}^{2 - }$中C原子价层电子对数为$3+\frac{4 + 2 - 2×3}{2}=3$,C轨道杂化类型为$sp^{2}$杂化,故C正确;D. $H_{2}O$中O原子价层电子对数为$2+\frac{6 - 2×1}{2}=4$,采用$sp^{3}$杂化,是V形结构,正负电荷中心不重叠,是极性分子,故D错误。
9. 亚硝酰氟(FNO)是一种工业稳定剂,可通过反应$N_{2}O_{4}+CsF\xlongequal {}FNO+CsNO_{3}$制得。下列说法正确的是 ( )
A.氧原子的结构示意图为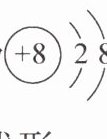
B.$CsF的电子式为Cs:\overset {.}{F}:$
C.FNO 的空间构型为直线形
D.$CsNO_{3}$中含有离子键与共价键
A.氧原子的结构示意图为
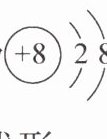
B.$CsF的电子式为Cs:\overset {.}{F}:$
C.FNO 的空间构型为直线形
D.$CsNO_{3}$中含有离子键与共价键
答案:
9.D 解析:A. O原子的质子数和电子数都是8,核外电子分层排布,其结构示意图为 ,故A错误;B. CsF为离子化合物,电子式为$Cs^{+}[:\ddot{F}:]^{-}$,故B错误;C. FNO中心原子N原子价层电子对数为$2+\frac{5 - 1×1 - 1×2}{2}=3$,空间构型为V形,故C错误;D. $CsNO_{3}$中含有$Cs^{+}$与$NO_{3}^{-}$间的离子键与$N - O$共价键,故D正确。
,故A错误;B. CsF为离子化合物,电子式为$Cs^{+}[:\ddot{F}:]^{-}$,故B错误;C. FNO中心原子N原子价层电子对数为$2+\frac{5 - 1×1 - 1×2}{2}=3$,空间构型为V形,故C错误;D. $CsNO_{3}$中含有$Cs^{+}$与$NO_{3}^{-}$间的离子键与$N - O$共价键,故D正确。
9.D 解析:A. O原子的质子数和电子数都是8,核外电子分层排布,其结构示意图为
 ,故A错误;B. CsF为离子化合物,电子式为$Cs^{+}[:\ddot{F}:]^{-}$,故B错误;C. FNO中心原子N原子价层电子对数为$2+\frac{5 - 1×1 - 1×2}{2}=3$,空间构型为V形,故C错误;D. $CsNO_{3}$中含有$Cs^{+}$与$NO_{3}^{-}$间的离子键与$N - O$共价键,故D正确。
,故A错误;B. CsF为离子化合物,电子式为$Cs^{+}[:\ddot{F}:]^{-}$,故B错误;C. FNO中心原子N原子价层电子对数为$2+\frac{5 - 1×1 - 1×2}{2}=3$,空间构型为V形,故C错误;D. $CsNO_{3}$中含有$Cs^{+}$与$NO_{3}^{-}$间的离子键与$N - O$共价键,故D正确。 10. 硫代碳酸钠$(Na_{2}CS_{3})$可用于处理工业废水中的重金属离子,可通过如下反应制备:$2NaHS+CS_{2}\xlongequal {}Na_{2}CS_{3}+H_{2}S\uparrow $。下列说法正确的是 (
A.NaHS 中仅存在离子键
B.$CS_{2}$的空间构型为直线形
C.$CS_{3}^{2-}$中 C 原子为$sp^{3}$杂化
D.$H_{2}S的电子式为H:S:H$
B
)A.NaHS 中仅存在离子键
B.$CS_{2}$的空间构型为直线形
C.$CS_{3}^{2-}$中 C 原子为$sp^{3}$杂化
D.$H_{2}S的电子式为H:S:H$
答案:
10.B解析:A. NaHS是酸式盐,其中存在离子键和共价键,A错误;B. $CS_{2}$分子结构与$CO_{2}$相似,C原子与2个S原子形成2个$C = S$共价键,三个原子在同一直线上,其空间构型为直线形,B正确;C. $CS_{3}^{2 - }$中C原子的价层电子对数是$3+\frac{4 + 2 - 2×3}{2}=3$,故C原子为$sp^{2}$杂化,C错误;D. S原子最外层有6个电子,S原子与2个H原子形成2对共用电子对,使分子中各个原子都达到稳定结构,故$H_{2}S$的电子式为$H:\ddot{S}:H$,D错误。
11. 反应$NO+NO_{2}+2NaOH\xlongequal {}2NaNO_{2}+H_{2}O$可用于吸收氮氧化物,下列说法正确的是 (
A.NO 和$NO_{2}$都是酸性氧化物
B.NaOH 的电子式为$Na:\overset {.}{O}:H$
C.$NaNO_{2}$中仅含有离子键
D.$H_{2}O$的空间构型为 V 形
D
)A.NO 和$NO_{2}$都是酸性氧化物
B.NaOH 的电子式为$Na:\overset {.}{O}:H$
C.$NaNO_{2}$中仅含有离子键
D.$H_{2}O$的空间构型为 V 形
答案:
11.D 解析:A. 一氧化氮是不成盐氧化物,故A错误;B. 氢氧化钠是离子化合物,电子式为$Na^{+}[:\ddot{O}:H]^{-}$,故B错误;C. 亚硝酸钠是含有离子键和共价键的离子化合物,故C错误;D. 水分子中氧原子的价层电子对数为4、孤对电子对数为2,分子的空间构型为V形,故D正确。
12. 用$NaClO氧化NH_{3}可制备火箭推进剂的燃料N_{2}H_{4}$。下列说法正确的是 (
A.$NH_{3}$是非极性分子
B.$NaClO$仅含离子键
C.$N_{2}H_{4}$中 N 元素的化合价为-2
D.中子数为 8 的氮原子可表示为$_{7}^{8}N$
C
)A.$NH_{3}$是非极性分子
B.$NaClO$仅含离子键
C.$N_{2}H_{4}$中 N 元素的化合价为-2
D.中子数为 8 的氮原子可表示为$_{7}^{8}N$
答案:
12.C解析:A. $NH_{3}$中含有极性键,空间结构为三角锥形,正负电荷的中心不重合,属于极性分子,选项A错误;B. NaClO含$Cl - O$共价键及离子键,选项B错误;C. 设肼中氮元素的化合价为x,根据在化合物中正负化合价代数和为零可得:$2x+( + 1)×4 = 0$,解得$x = - 2$,选项C正确;D. 中子数为8的氮原子,质量数为15,可表示为$_{7}^{15}N$,选项D错误。
13. 下列化学用语或表述正确的是 (
A.$BeCl_{2}$的空间结构:V 形
B.$P_{4}$中的共价键类型:非极性键
C.基态 Ni 原子价电子排布式:$3d^{10}$
D.顺-2-丁烯的结构简式: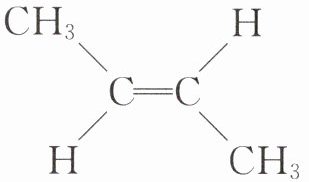
B
)A.$BeCl_{2}$的空间结构:V 形
B.$P_{4}$中的共价键类型:非极性键
C.基态 Ni 原子价电子排布式:$3d^{10}$
D.顺-2-丁烯的结构简式:

答案:
13.B解析:A. $BeCl_{2}$的中心原子为Be,根据VSEPR模型可以计算,$BeCl_{2}$中不含有孤电子对,因此$BeCl_{2}$为直线型分子,A错误;B. $P_{4}$分子中相邻两P原子之间形成共价键,同种原子之间形成的共价键为非极性共价键,$P_{4}$分子中的共价键类型为非极性共价键,B正确;C. Ni原子的原子序数为28,其基态原子的价电子排布为$3d^{8}4s^{2}$,C错误;D. 顺 - 2 - 丁烯的结构中两个甲基在双键的同一侧,其结构简式为$H_{3}C-\overset{CH_{3}}{\underset{HC = CH}{\overset{\mid}{}}}$,D错误。
14. 下列化学用语表示正确的是 ( )
A.中子数为 16 的磷原子:$_{15}^{16}P$
B.乙烯的空间填充模型
C.氧原子核外电子轨道表示式:
D.乙醇的键线式: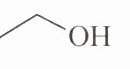
A.中子数为 16 的磷原子:$_{15}^{16}P$
B.乙烯的空间填充模型

C.氧原子核外电子轨道表示式:

D.乙醇的键线式:

答案:
14.D解析:A. 磷的质子数为15,中子数为16,则质量数为31,此磷原子可表示为$_{15}^{31}P$,A不正确;B. 乙烯的球棍模型为: ,空间填充模型为![img alt=14B填充],B不正确;C. 依据洪特规则,氧原子的最外层p轨道中电子应尽可能分占不同的轨道,则其核外电子轨道表示式为:![img alt=14C],C不正确;D. 乙醇的结构简式为$CH_{3}CH_{2}OH$,则其键线式:
,空间填充模型为![img alt=14B填充],B不正确;C. 依据洪特规则,氧原子的最外层p轨道中电子应尽可能分占不同的轨道,则其核外电子轨道表示式为:![img alt=14C],C不正确;D. 乙醇的结构简式为$CH_{3}CH_{2}OH$,则其键线式: OH,D正确。
OH,D正确。
14.D解析:A. 磷的质子数为15,中子数为16,则质量数为31,此磷原子可表示为$_{15}^{31}P$,A不正确;B. 乙烯的球棍模型为:
 ,空间填充模型为![img alt=14B填充],B不正确;C. 依据洪特规则,氧原子的最外层p轨道中电子应尽可能分占不同的轨道,则其核外电子轨道表示式为:![img alt=14C],C不正确;D. 乙醇的结构简式为$CH_{3}CH_{2}OH$,则其键线式:
,空间填充模型为![img alt=14B填充],B不正确;C. 依据洪特规则,氧原子的最外层p轨道中电子应尽可能分占不同的轨道,则其核外电子轨道表示式为:![img alt=14C],C不正确;D. 乙醇的结构简式为$CH_{3}CH_{2}OH$,则其键线式: OH,D正确。
OH,D正确。 查看更多完整答案,请扫码查看


