第65页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
20. (6 分)(2025·重庆期末节选)某学习小组对铁锈蚀进行探究。
【提出问题】铁锈蚀与哪些因素有关?
【查阅资料】Ⅰ. 氯化钙固体可作干燥剂。Ⅱ. 一定条件下,碳可加快铁的锈蚀,但碳本身不参加反应。
【设计与实验】
实验一:定性探究铁锈蚀的因素
取四枚相同的洁净无锈铁钉分别放入试管,进行如图 1 实验,现象如表所示。
| 试管 | A | B | C | D |
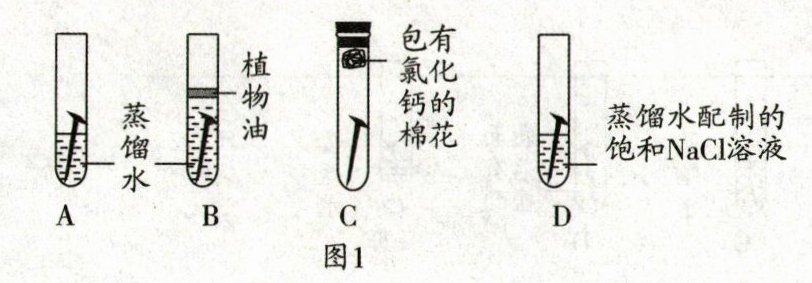

| 一周后铁钉表面现象 | 有一层铁锈 | 无明显变化 | 无明显变化 | 有较厚铁锈 |
(1)对比 A、B、C 试管中实验现象,说明铁锈蚀主要是铁与空气中的
(2)生活中铁制品易生锈,铝更活泼但铝制品不易生锈的原因是
通过对比 A、D 试管中实验现象,发现铁锈蚀快慢与饱和 $ \text{NaCl} $ 溶液有关,于是设计了如下实验。
实验二:定量探究铁锈蚀的因素
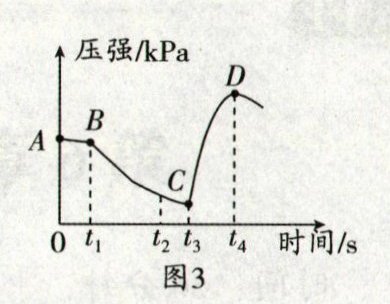
小组设计了图 2 装置,检查气密性后,将 5 g 铁粉和 2 g 炭粉加入三颈烧瓶。 $ t_1 $ 时刻加入 2 mL 饱和 $ \text{NaCl} $ 溶液。一段时间后,再用注射器将 5 mL 稀盐酸注入三颈烧瓶中。整个过程采集的数据如图 3。
(3)根据图 3,对比 $ AB $ 段和
【提出问题】铁锈蚀与哪些因素有关?
【查阅资料】Ⅰ. 氯化钙固体可作干燥剂。Ⅱ. 一定条件下,碳可加快铁的锈蚀,但碳本身不参加反应。
【设计与实验】
实验一:定性探究铁锈蚀的因素
取四枚相同的洁净无锈铁钉分别放入试管,进行如图 1 实验,现象如表所示。
| 试管 | A | B | C | D |


| 一周后铁钉表面现象 | 有一层铁锈 | 无明显变化 | 无明显变化 | 有较厚铁锈 |
(1)对比 A、B、C 试管中实验现象,说明铁锈蚀主要是铁与空气中的
O₂
、H₂O
(填化学式)发生化学反应。(2)生活中铁制品易生锈,铝更活泼但铝制品不易生锈的原因是
铝能和氧气反应生成致密的氧化铝保护膜(合理即可)
。通过对比 A、D 试管中实验现象,发现铁锈蚀快慢与饱和 $ \text{NaCl} $ 溶液有关,于是设计了如下实验。
实验二:定量探究铁锈蚀的因素
小组设计了图 2 装置,检查气密性后,将 5 g 铁粉和 2 g 炭粉加入三颈烧瓶。 $ t_1 $ 时刻加入 2 mL 饱和 $ \text{NaCl} $ 溶液。一段时间后,再用注射器将 5 mL 稀盐酸注入三颈烧瓶中。整个过程采集的数据如图 3。
(3)根据图 3,对比 $ AB $ 段和
BC
段,说明 $ \text{NaCl} $ 溶液可加快铁生锈的速率。 $ t_3 $ 时刻后压强突然变大,原因是Fe+2HCl=FeCl₂+H₂↑
(请用化学方程式解释)。
答案:
(1)O₂ H₂O
(2)铝能和氧气反应生成致密的氧化铝保护膜(合理即可)
(3)BC Fe+2HClFeCl₂+H₂↑
(1)O₂ H₂O
(2)铝能和氧气反应生成致密的氧化铝保护膜(合理即可)
(3)BC Fe+2HClFeCl₂+H₂↑
查看更多完整答案,请扫码查看


