第114页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
21. (10 分)(2025·济南期末)如图所示为实验室中常见气体制备、净化、干燥、收集和进行实验探究的部分仪器(组装实验装置时,可重复选择仪器),某小组的同学利用其进行下列各实验。
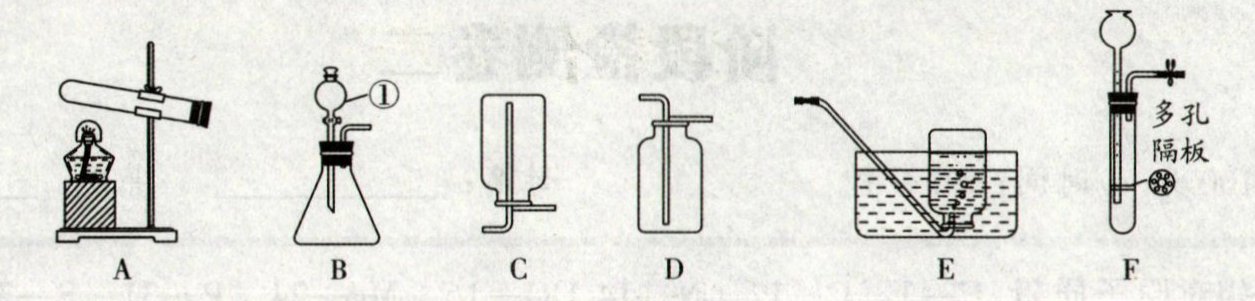
(1)氢气是最理想的能源,实验室常用锌粒和稀硫酸制取。若制取并收集较干燥的氢气,应选择的装置组合是
(2)碳和水蒸气在高温条件下反应也会生成氢气,同时生成碳的氧化物。为探究该反应生成气体的成分,化学兴趣小组进行了如下实验(部分步骤及装置已省略)。
【猜想与假设】气体成分有 H2还有 CO 和 CO2中的一种或两种。
【查阅资料】Ⅰ.H2具有还原性。Ⅱ.无水硫酸铜是一种白色固体,遇水会变成蓝色。
【设计并进行实验】如图所示:将反应生成的气体通过 C1→B→A→D→E→C2的顺序连接,检查装置的气密性,然后进行实验。
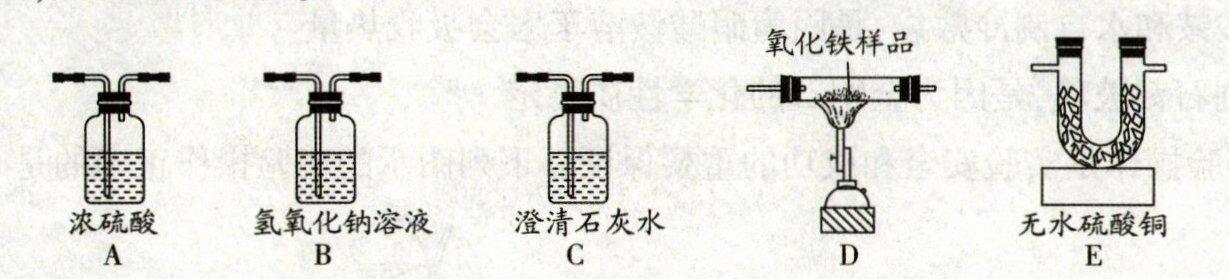
①C1装置的作用是
【实验现象与结论】
②C1中无明显现象。C2中澄清石灰水变浑浊;E 装置中无水硫酸铜变蓝,D 装置中固体的颜色变化为
③由此得出:碳和水蒸气在高温条件下反应生成
④若氧化铁样品的质量为 12 g(杂质不参与反应),反应完成后,固体质量减少 2.4 g,则样品中氧化铁的质量分数为
【反思与评价】⑤从环保角度考虑,该实验存在的不足是

(1)氢气是最理想的能源,实验室常用锌粒和稀硫酸制取。若制取并收集较干燥的氢气,应选择的装置组合是
BC
(填字母),该反应的化学方程式为Zn+H₂SO₄=ZnSO₄+H₂↑
。若选用 F 装置制氢气,其优点是可以控制反应的发生和停止
。(2)碳和水蒸气在高温条件下反应也会生成氢气,同时生成碳的氧化物。为探究该反应生成气体的成分,化学兴趣小组进行了如下实验(部分步骤及装置已省略)。
【猜想与假设】气体成分有 H2还有 CO 和 CO2中的一种或两种。
【查阅资料】Ⅰ.H2具有还原性。Ⅱ.无水硫酸铜是一种白色固体,遇水会变成蓝色。
【设计并进行实验】如图所示:将反应生成的气体通过 C1→B→A→D→E→C2的顺序连接,检查装置的气密性,然后进行实验。

①C1装置的作用是
检验二氧化碳
;A 装置的作用是吸收水蒸气
。【实验现象与结论】
②C1中无明显现象。C2中澄清石灰水变浑浊;E 装置中无水硫酸铜变蓝,D 装置中固体的颜色变化为
红棕色固体变黑色
,写出 C2中发生反应的化学方程式:Ca(OH)₂+CO₂=CaCO₃↓+H₂O
。③由此得出:碳和水蒸气在高温条件下反应生成
氢气和一氧化碳
,写出 D 中发生反应的一个化学方程式:Fe₂O₃+3H₂$\stackrel{高温}{=}$2Fe+3H₂O(或Fe₂O₃+3CO$\stackrel{高温}{=}$2Fe+3CO₂)
。④若氧化铁样品的质量为 12 g(杂质不参与反应),反应完成后,固体质量减少 2.4 g,则样品中氧化铁的质量分数为
66.7%
(保留一位小数)。【反思与评价】⑤从环保角度考虑,该实验存在的不足是
没有处理尾气
。
答案:
(1)BC Zn+H₂SO₄=ZnSO₄+H₂↑ 可以控制反应的发生和停止
(2)①检验二氧化碳 吸收水蒸气 ②红棕色固体变黑色 Ca(OH)₂+CO₂=CaCO₃↓+H₂O ③氢气和一氧化碳 Fe₂O₃+3H₂$\stackrel{高温}{=}$2Fe+3H₂O(或Fe₂O₃+3CO$\stackrel{高温}{=}$2Fe+3CO₂) ④66.7% ⑤没有处理尾气
(1)BC Zn+H₂SO₄=ZnSO₄+H₂↑ 可以控制反应的发生和停止
(2)①检验二氧化碳 吸收水蒸气 ②红棕色固体变黑色 Ca(OH)₂+CO₂=CaCO₃↓+H₂O ③氢气和一氧化碳 Fe₂O₃+3H₂$\stackrel{高温}{=}$2Fe+3H₂O(或Fe₂O₃+3CO$\stackrel{高温}{=}$2Fe+3CO₂) ④66.7% ⑤没有处理尾气
22. (8 分)AgNO3溶液是实验室中的常用试剂。AgNO3的化学性质不稳定,在温度稍高或光照条件下可以发生反应:2AgNO3$\xlongequal{光照}$2Ag↓+2NO2↑+O2↑(假设气体全部逸出)。现有一瓶 100 g 10%的 AgNO3溶液,久置后(不考虑水分挥发),将瓶内物质过滤,得到固体 1.08 g 和若干滤液。试计算:
(1)滤液中 AgNO3的质量分数(结果精确到 0.1%)。
(2)若要将滤液中的 AgNO3恢复到原来的质量分数,并把溶液质量增加到 200 g。应在滤液中加入一定量水和 AgNO3固体,计算加入 AgNO3的质量。
(1)滤液中 AgNO3的质量分数(结果精确到 0.1%)。
(2)若要将滤液中的 AgNO3恢复到原来的质量分数,并把溶液质量增加到 200 g。应在滤液中加入一定量水和 AgNO3固体,计算加入 AgNO3的质量。
答案:
(1)解:设参加反应硝酸银的质量为x,生成二氧化氮的质量为y,生成氧气的质量为z,2AgNO₃$\stackrel{光照}{=}$2Ag↓+2NO₂↑+O₂↑340 216 92 32x 1.08g y z$\frac{340}{216}$=$\frac{x}{1.08g}$ x=1.7g$\frac{216}{92}$=$\frac{1.08g}{y}$ y=0.46g$\frac{216}{32}$=$\frac{1.08g}{z}$ z=0.16g滤液中AgNO₃的质量分数为$\frac{100g×10\%-1.7g}{100g-1.08g-0.46g-0.16g}$×100%≈8.4%。答:滤液中AgNO₃的质量分数为8.4%。
(2)解:设加入AgNO₃的质量为m,则200g×10%=100g×10%-1.7g+m,m=11.7g。答:加入AgNO₃的质量为11.7g。
(1)解:设参加反应硝酸银的质量为x,生成二氧化氮的质量为y,生成氧气的质量为z,2AgNO₃$\stackrel{光照}{=}$2Ag↓+2NO₂↑+O₂↑340 216 92 32x 1.08g y z$\frac{340}{216}$=$\frac{x}{1.08g}$ x=1.7g$\frac{216}{92}$=$\frac{1.08g}{y}$ y=0.46g$\frac{216}{32}$=$\frac{1.08g}{z}$ z=0.16g滤液中AgNO₃的质量分数为$\frac{100g×10\%-1.7g}{100g-1.08g-0.46g-0.16g}$×100%≈8.4%。答:滤液中AgNO₃的质量分数为8.4%。
(2)解:设加入AgNO₃的质量为m,则200g×10%=100g×10%-1.7g+m,m=11.7g。答:加入AgNO₃的质量为11.7g。
查看更多完整答案,请扫码查看


