第90页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
1. 铁矿石炼成铁是一个复杂的过程。工业上炼铁的过程如图所示,下列说法中,错误的是( )
赤铁矿石、焦炭、石灰石(主要成分为$CaCO_{3}$)
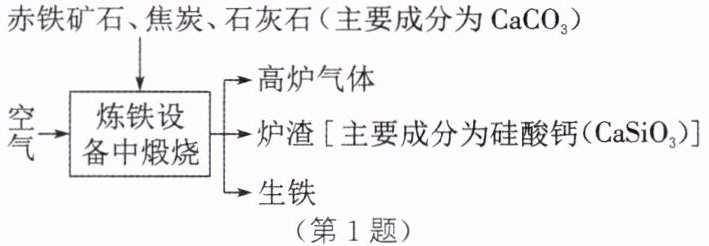
A.炼铁的设备是高炉
B.所得生铁属于混合物
C.焦炭的主要作用是提供热量、产生二氧化碳
D.石灰石的作用是与铁矿石中的杂质反应形成炉渣
赤铁矿石、焦炭、石灰石(主要成分为$CaCO_{3}$)

A.炼铁的设备是高炉
B.所得生铁属于混合物
C.焦炭的主要作用是提供热量、产生二氧化碳
D.石灰石的作用是与铁矿石中的杂质反应形成炉渣
答案:
C
2. 某化学兴趣小组的同学利用如图所示的装置来模拟工业炼铁原理,请按要求填空。
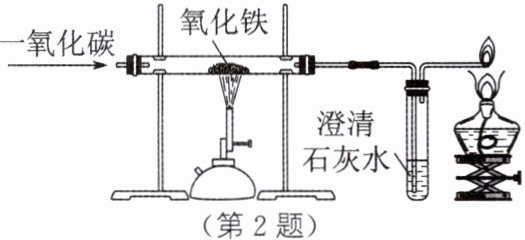
(1)实验中硬质玻璃管内观察到的现象是______。
(2)右边导气管口放置点燃的酒精灯的目的是______。
(3)上述实验中,CO起到以下三个作用:① 作为反应物;② 实验开始时,先排尽装置中的空气,防止______;③ 加热后,继续通入气体,防止______。

(1)实验中硬质玻璃管内观察到的现象是______。
(2)右边导气管口放置点燃的酒精灯的目的是______。
(3)上述实验中,CO起到以下三个作用:① 作为反应物;② 实验开始时,先排尽装置中的空气,防止______;③ 加热后,继续通入气体,防止______。
答案:
(1)红棕色固体变成黑色 (2)尾气处理,防止一氧化碳污染环境 (3)② 一氧化碳和空气混合加热时发生爆炸 ③ 生成的铁在高温下再次被氧化(合理答案均可)
3. 我国高铁建设走在世界前列,修建高铁需要大量铁矿石来炼铁,进而炼钢。
(1)有三种铁矿石的主要成分分别为$Fe_{2}O_{3}$、$Fe_{3}O_{4}$、$FeCO_{3}$,其中含铁量最高的是______。
(2)要炼出含铁96%的生铁1000 t,至少需要含氧化铁80%的赤铁矿多少吨?若高炉气体不加以处理,则理论上会向大气中排放$CO_{2}$多少吨?(结果精确到1吨)
(1)有三种铁矿石的主要成分分别为$Fe_{2}O_{3}$、$Fe_{3}O_{4}$、$FeCO_{3}$,其中含铁量最高的是______。
(2)要炼出含铁96%的生铁1000 t,至少需要含氧化铁80%的赤铁矿多少吨?若高炉气体不加以处理,则理论上会向大气中排放$CO_{2}$多少吨?(结果精确到1吨)
答案:
(1)Fe₃O₄ (2)解:设至少需要含氧化铁80%的赤铁矿的质量为x,反应产生CO₂的质量为y。
Fe₂O₃+3CO$\frac{\underline{\;高温\;}}{}$2Fe+3CO₂
160 112 132
x×80% 1000 t×96% y
$\frac{160}{112}$=$\frac{x×80\%}{1000\;t×96\%}$ x≈1714 t
$\frac{112}{132}$=$\frac{1000\;t×96\%}{y}$ y≈1131 t
答:至少需要含氧化铁80%的赤铁矿1714 t。理论上会向大气中排放1131 t CO₂。
Fe₂O₃+3CO$\frac{\underline{\;高温\;}}{}$2Fe+3CO₂
160 112 132
x×80% 1000 t×96% y
$\frac{160}{112}$=$\frac{x×80\%}{1000\;t×96\%}$ x≈1714 t
$\frac{112}{132}$=$\frac{1000\;t×96\%}{y}$ y≈1131 t
答:至少需要含氧化铁80%的赤铁矿1714 t。理论上会向大气中排放1131 t CO₂。
4. 新考法·创新实验 某化学兴趣小组的同学设计如图所示装置进行“一氧化碳还原氧化铁”及产物检验的实验[已知:$HCOOH(甲酸)\xlongequal[\triangle]{浓硫酸}CO\uparrow +H_{2}O$]。下列说法中,不正确的是( )
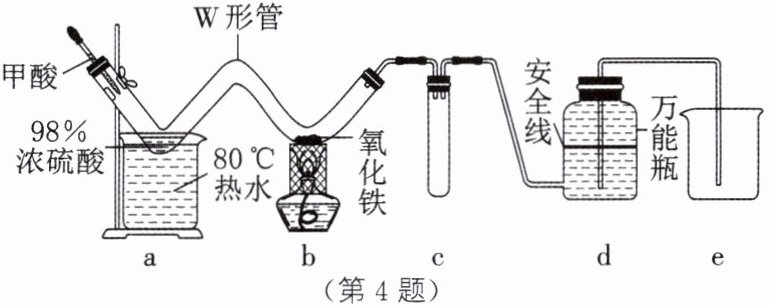
A.在制一氧化碳的过程中,浓硫酸作为催化剂,浓度和质量保持不变
B.用磁铁来拉动黑色固体进入a装置,可以证明铁的存在
C.d装置的作用较多,起到安全、环保及初步判断反应的发生与结束的作用
D.实验前,在a装置的左端添加注射器向装置中推入空气,通过d装置中是否有气泡,判断气密性

A.在制一氧化碳的过程中,浓硫酸作为催化剂,浓度和质量保持不变
B.用磁铁来拉动黑色固体进入a装置,可以证明铁的存在
C.d装置的作用较多,起到安全、环保及初步判断反应的发生与结束的作用
D.实验前,在a装置的左端添加注射器向装置中推入空气,通过d装置中是否有气泡,判断气密性
答案:
A 解析:由HCOOH(甲酸)$\frac{\underline{\;浓硫酸\;}}{\triangle }$CO↑+H₂O可知,在制一氧化碳的过程中,浓硫酸作为催化剂,硫酸的质量不变,但由于生成了水,浓硫酸浓度减小,A说法错误。铁能被磁铁吸引,用磁铁来拉动黑色固体进入a装置,可以证明铁的存在,B说法正确。d装置的作用较多,可以收集未反应的一氧化碳,可以判断反应的发生与结束,最初可以检验是否排尽装置中的空气,防止加热时气体不纯发生爆炸,起安全作用,C说法正确。实验前,在a装置的左端添加注射器向装置中推入空气,若d装置中有气泡产生,说明气密性良好,D说法正确。
5. A~G表示初中化学常见的物质,它们之间的转化关系如图所示(部分反应物、生成物和反应条件已略去)。其中B为红棕色粉末,F为红色固体,D、E、F均为单质,G为黑色物质,C能使澄清石灰水变浑浊(已知:铁能与硫酸铜反应生成铜和硫酸亚铁)。
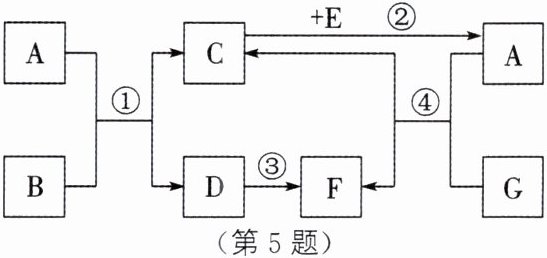
(1)物质G的化学式为______。
(2)反应②属于基本反应类型中的______。
(3)写出下列反应的化学方程式。
反应③:______。
反应④:______。

(1)物质G的化学式为______。
(2)反应②属于基本反应类型中的______。
(3)写出下列反应的化学方程式。
反应③:______。
反应④:______。
答案:
(1)B (2)① 先通一会儿一氧化碳,排尽玻璃管内的空气 ② 3CO+Fe₂O₃$\frac{\underline{\;高温\;}}{}$2Fe+3CO₂ ③ 收集一氧化碳气体,防止一氧化碳逸出而污染空气 ④ 8 (3)Fe₂O₃和Fe(或Fe₂O₃和FeO;或Fe₂O₃和Fe₃O₄等合理答案均可,必须含有Fe₂O₃) (4)① Fe₃O₄+H₂$\frac{\underline{\;600~650{\hspace{0pt}}^{\circ }\mathrm{C}\;}}{}$3FeO+H₂O ② Fe 解析:(1)电解氧化铝的化学方程式为2Al₂O₃$\frac{\underline{\;通电\;}}{}$4Al+3O₂↑,属于分解反应。(2)① 一氧化碳中混有氧气或空气,在点燃或加热情况下可能发生爆炸,所以在加热前要先通一会儿CO,排尽玻璃管内的空气。② 实验时装置A的玻璃管内发生反应的化学方程式为3CO+Fe₂O₃$\frac{\underline{\;高温\;}}{}$2Fe+3CO₂。③ 一氧化碳是有毒气体,需要进行尾气处理,装置B除了吸收CO₂气体外,还有收集尾气(CO),防止尾气污染空气的作用。④ 氧化铁中铁元素与氧元素的质量比为(56×2):(16×3)=7:3,由题意知氧化铁中氧元素质量为2.4 g,故铁元素的质量为2.4 g×$\frac{7}{3}$=5.6 g,则反应前氧化铁的质量为2.4 g+5.6 g=8 g。(3)FeO中Fe和O的质量比为56:16=7:2>5:2;Fe₃O₄中Fe和O的质量比为(56×3):(16×4)=21:8>5:2;Fe₂O₃中Fe和O的质量比为(56×2):(16×3)=7:3<5:2;Fe单质中不含氧元素;由于反应后固体中Fe和O的质量比为5:2,所以反应后的固体中一定含有Fe₂O₃,其组成情况可能有Fe₂O₃和Fe;Fe₂O₃和FeO;Fe₂O₃和Fe₃O₄;Fe₂O₃和FeO、Fe;Fe₂O₃和Fe₃O₄、Fe;Fe₂O₃和Fe₃O₄、FeO;Fe₂O₃和Fe₃O₄、FeO、Fe。(4)① 铁的氧化物有Fe₂O₃、Fe₃O₄、FeO,其中所含氧元素的质量分数分别为30%、27.6%、22.2%,从a到d点,固体中的含氧量逐渐变小。b点对应固体残留率为97%,则剩余固体质量为4.8 g×97%=4.656 g,铁元素质量不变,为4.8 g×($\frac{56×2}{56×2+16×3}$×100%)=3.36 g,则b点对应固体中铁元素与氧元素的原子个数比为$\frac{3.36\;g}{56}$:$\frac{4.656\;g-3.36\;g}{16}$≈3:4,故b点对应固体为四氧化三铁(Fe₃O₄);c点对应固体残留率为90%,则剩余固体质量为4.8 g×90%=4.32 g,则c点对应固体中铁元素与氧元素的原子个数比为$\frac{3.36\;g}{56}$:$\frac{4.32\;g-3.36\;g}{16}$=1:1,故c点对应固体为氧化亚铁(FeO),则bc段发生反应的化学方程式为H₂+Fe₃O₄$\frac{\underline{\;600~650{\hspace{0pt}}^{\circ }\mathrm{C}\;}}{}$3FeO+H₂O。② d点对应固体质量=反应前氧化铁的质量×固体残留率=4.8 g×70%=3.36 g,等于原固体中铁元素的质量,所以d点对应的固体为Fe。
查看更多完整答案,请扫码查看


